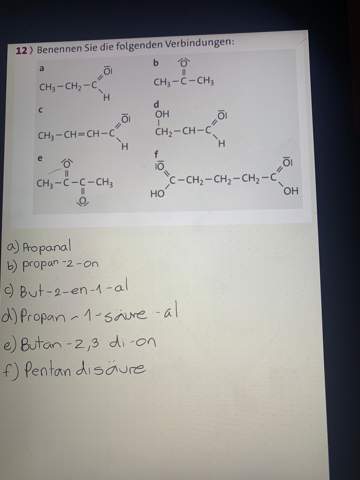
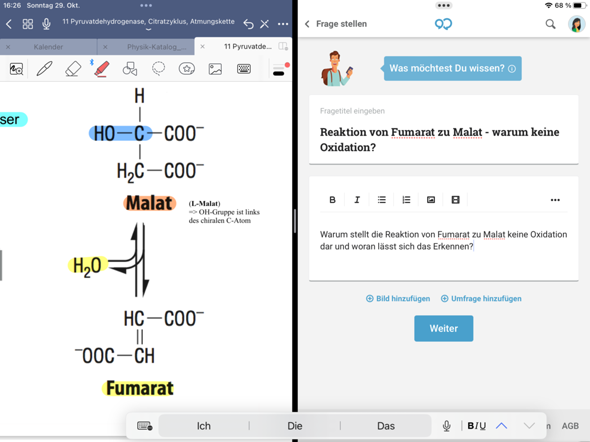
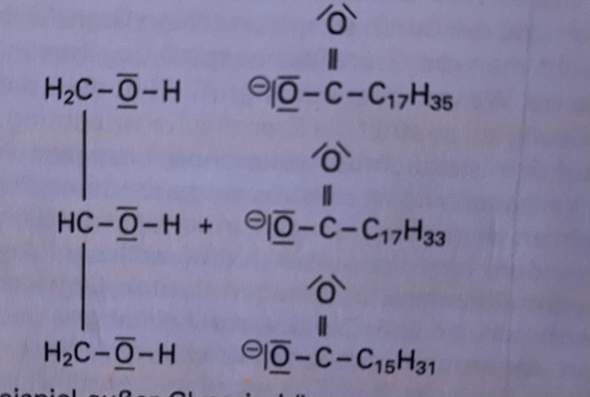
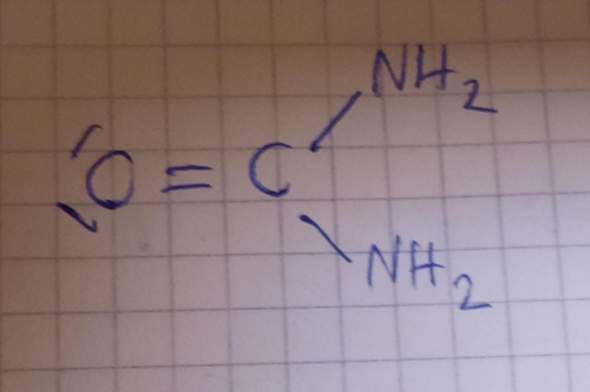
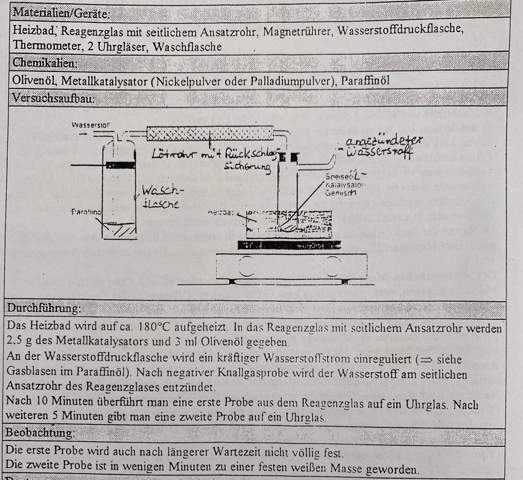
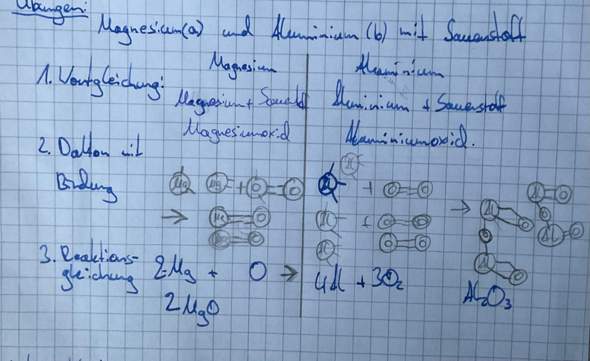
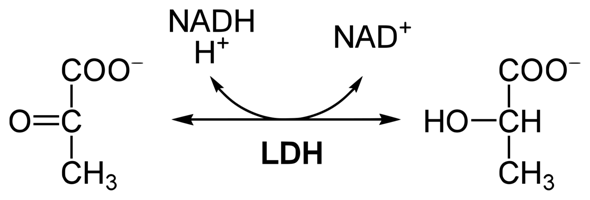
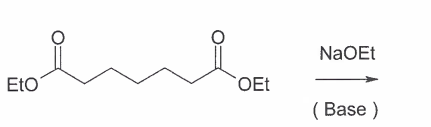
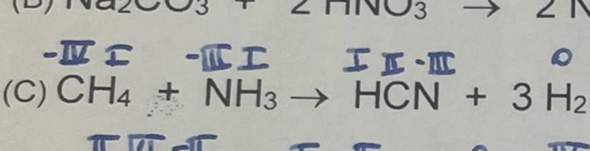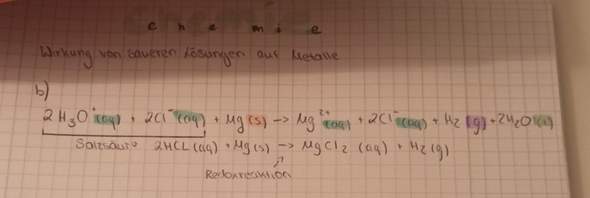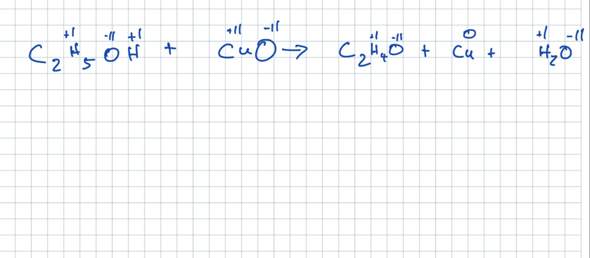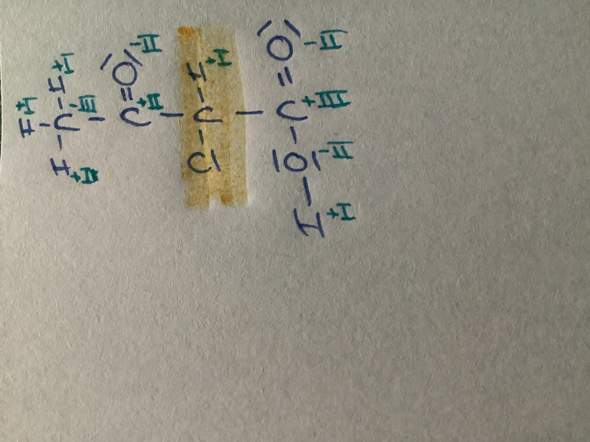😩Hach ja, man müßte Klavier spielen können✨
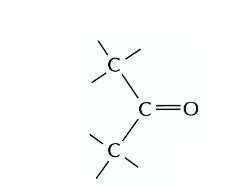
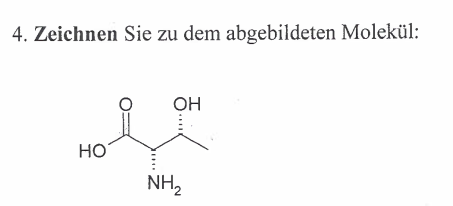
Zu folgendem Molekül soll die Fischer-Projektion gezeichnet werden
Wir wissen schon, daß die Carbonsäure-Gruppe ganz links die höchste funktionelle Gruppe ist und daher ganz oben hin muss. Ganz rechts hängt nur ein C-Atom, also muß das ganz unten. Jetzt gehts also nur noch um die beiden Substituenten, also die OH-Gruppe und die NH2-Gruppe.
Wir haben uns das Video vom sehr empfehlenswerten YouTuber chemistrykicksass angesehen, wo er sagt, daß man bei der Fischer-Projektion das Molekül so um 90 Grad drehen muß, dass die höchstpriorisiertes C-Atom ganz oben ist und das niedrigste ganz unten. z.b bei der D-Glucose so:
Dann meinte er daß überall wo eine fette Linie ist (also zum Betrachter hinzeigen), die Substituenten ihre Seiten wechseln (also von links nach rechts oder vice versa); während die Substiutenen, die an einer gestrichelten Linie hängen an ihrer Seite bleiben. Das sähe dann summa summarum so aus:
So weit, so gut! Jetzt wollten wir das ganze Mal auf unser Molekül in der Aufgabenstellung anwenden. Wenn wir den ganzen Spaß um 90 Grad drehen, so daß der höchstprioriersierte C-Atom ganz obbe ist und der niedrig-priorisiertes ganz unne, dann sieht der Spaß so aus:
Demzufollge ist NH2 links und OH rechts. Beide haben gestrichelte Linien. Müssen also ihre Position nicht tauschen. Dann sähe die Fischer-Projektion so aus:
So, jetzt steht aber in unser Lösung folgendes:
Also genau umgekehrt wie wir es mit dem Erklärungsansatz vom YouTube-Video versucht haben.
Ich kann mir schwer vorstellen, daß unser Professor Bullshit erzählt hat, nachdem er sich sogar damit rühmt Dokotrand von Cahn Ingold-Prelog persönlich gewesen zu sein. Warum hat er also das NH2 auf die rechte Seite geschrieben und OH links, wenn man doch bei gestrichelten Linien die Substituenten auf ihrer Seite lassen soll?
(Als Referenz verlink ich nochmal dazugehörigen Video: https://www.youtube.com/watch?v=ixGlFweU_9M)