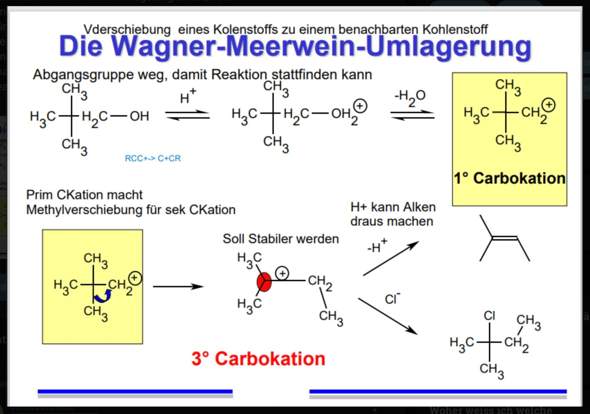
Wie funktioniert hier die Wagner Meerwein Umlagerung?
Also hier sieht man ja, dass eine ,,Methylverschiebung‘‘ stattfindet? Wodurch wird die denn genau veranlasst? Also, ist da irgendwie ein negativer Ladungsschwerpunkt, sodass es die Position zu einem tertiären Carbokation wechselt ? Das tertiäre ist ja einfach stabiler demnach istder Wechsel dazu ja nachvollziehbar, aber das ganze muss doch irgendwie durch anziehende Ladungen gestartet werden, dass es dazu kommt, weil die vorhandene Bindung zu brechen doch sicherlich Energie kostet.
Genau so hier. Für mich ist es verständlich, dass nach einem stabileren Zustand gestrebt wird. Durch die Wagner Meerwein Umlagerung bekommt man hier ein tertiäres Carbokation anstatt eines sekundären. Trotzdem verstehe ich nicht so ganz, durch welche ,,Kraft‘‘ das veranlasst wird oder was für Anziehungen da bestehen, dass es zu dem Wechsel kommt.
Ich hoffe mein Problem ist nachvollziehbar. Die Reaktion ist aus einem YouTube Video und das grüne habe ich nur dazugeschrieben.