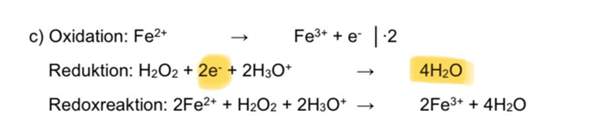
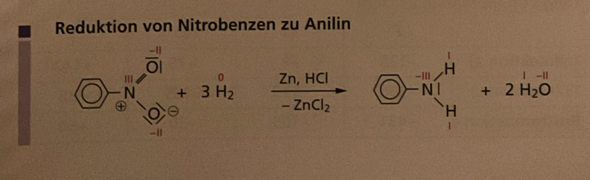
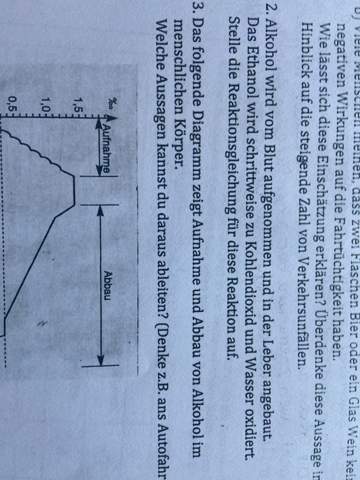
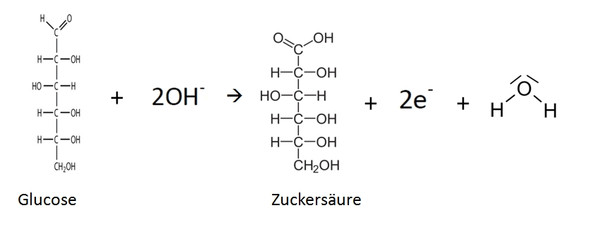
sind bräunliche Knicke oder angelaufene Schnittstellen im Salat schädlich?
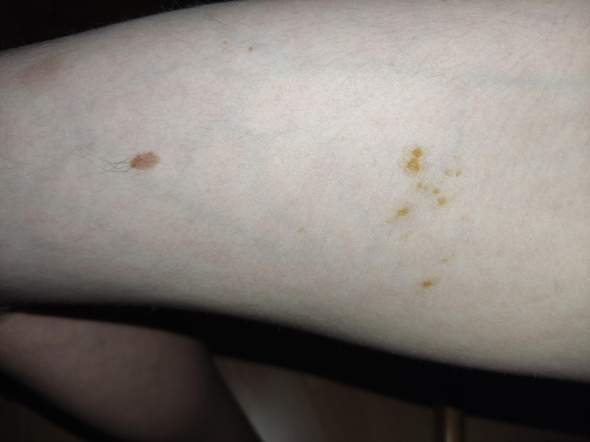
wenn ein Salatblatt, z.B. bei einem Eisbergsalat, geknickt wird, so ist meist schon am nächsten Tag eine bräunliche oder rötliche Verfärbung zu erkennen. Ebenso bei einer Schnittstelle, wenn der Salatkopf z.B. in der Mitte geteilt wird für eine spätere Verwendung. Manchmal wasche ich auch zu viel und hebe den Rest in einer Frischebox für den nächsten Tag auf. Der Salat ist ja noch frisch und knackig und nicht faulig, das Anlaufen hat wohl eher etwas mit einer Oxidation zu tun. Ich spreche hier von Eigenbedarf und würde natürlich nicht einen braunen Salat kaufen oder im Restaurant akzeptieren, aber zu Hause weiß ich ja, dass er erst kürzlich aufgeschnitten wurde.
Nun hat mir jemand erklärt, dass hier angeblich schädliche oder sogar Giftstoffe entstehen... Muss ich alles bräunliche wegschneiden, sollte es (nochmals) gewaschen werden oder ist es eigentlich egal (was ich bisher immer dachte). Wie gesagt, ich rede NICHT von fauligen oder lappigen Blättern, die ich ja sowieso wegtue!!
Schließlich liegen die Fertigmischungen ja auch einige Tage im Kühlregal herum - ok, wir wissen, dass diese nochmals gewaschen werden müssen wegen der Bakterien, aber hier geht es um die Oxidation (oder was auch immer) der Schnitt- oder Rissflächen.
Wo sind die Lebensmittel-Techniker, die kompetente Auskunft geben können?