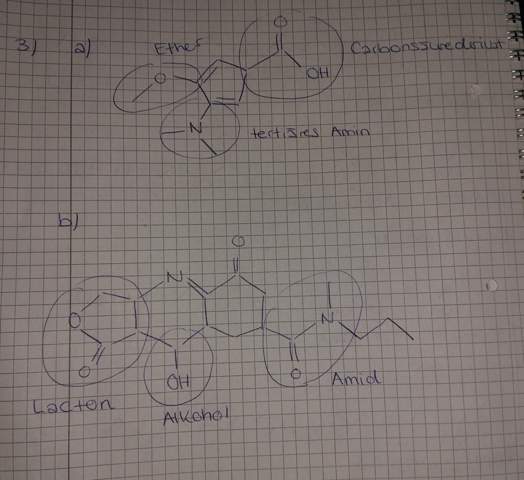
Einfluss der Molekülstruktur auf Säurestärke?
Moin, es ergibt sich bei mir folgendes Problem:
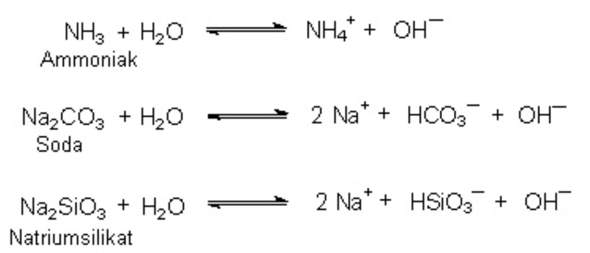
Säurestärke innerhalb der Hauptgruppe:
Bsp.: Hauptgruppe VII - Halogenwasserstoffe
- HF hat einen pks-Wert von 3,17 und eine END von 1,9
- HI hat einen pks-Wert von -10 und eine END von 0,4
--> HI ist also die stärkere Säure. Die Bindung ist leicht spaltbar, man könnte also denken, dass dies ein Grund für die größere Säurestärke ist.
Säurestärke innerhalb der Periode:
Bsp.: Periode 2
- H20 hat einen pks-Wert von 15,74 und eine END von 1,4
- HF --> siehe oben
--> Hier verhält es sich mit der END genau umgekehrt. Das Molekül mit der stärkeren Bindung, besitzt die größere Säurestärke.
Also wie kann das sein, was ist richtig und was habe ich übersehen...
Viele Grüße,
Lars