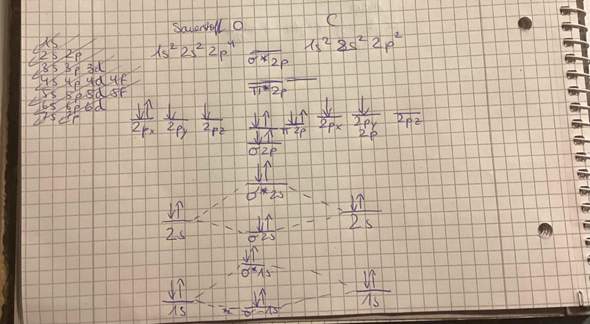
Also die linke Zeichnung nennt man nach IUPAC ja cis-1,2-Dimethylcyclobutan, weil beide Substituenten nach ,,vorne’‘ zeigen. Jedoch kann man nach dieser R und S Konfiguration die beiden Substituenten an den Stellen 1 und 2 auch als R oder S klassifizieren (so wie ich es verstanden habe)
Der erste Schritt ist da ja die Chiralitätszentren zu finden und das ist für meine Zeichnung ja am 1. und 2. C-Atom vom Cyclobutan. Wie man in dem 2. Foto sieht, muss man dann die Prioritäten der Bindungspartner bestimmen und die Richtung in der man zählt entscheidet über R oder S.
Wo liegt bei mir der Fehler? H hat ja meistens die niedrigste Priorität, dann schaut man weiter. Die anderen Bindungspartner sind ja alles C-Atome, und da muss man dann um einen Schritt immer weiterschauen.
Ich habe da gedacht, dass das eine C ja mit 2 weiteren C und 1 H verbunden ist (Priorität 1), das andere mit 1 C und 2H (Priorität 2) und das andere C mit 3H verbunden ist (Priorität 3)
Zählt die Nummer 4 nicht mit in die Zählrichtung? Weil das würde für meine Skizze (Bild 1) und die Erklärung (Bild 2) ja dann keinen Kreis ergeben. Warum zählt man das H anscheinend nicht mit?Ich habe es ja mit einem durchgezogenen Strich gemalt, aber im 2. Bild ist es gestrichelt. Liegt es daran? Und woher weiß ich immer, dass es gestrichelt sein muss?
Vielen Dank schon mal für Antworten, falls welche kommen werden :)