Ist das richtig? Phosphor?
ist die Struktur von weißen und roten Phosphor richtig gezeichnet und wie ist sind die Atome beim weißen geladen ?

1 Antwort
Dein weißer Phosphor ist richtig (da gibt es keine Ladungen), aber beim Roten Phosphor weiß ich nicht, was Du damit ausdrücken willst. Er ist ganz bestimmt keine Ionenverbindung, sondern hat eine komplizierte, unregelmäßige Struktur, die auch ein bißchen von den Herstellungsbedingungen abhängt, mit verschiedenen Strukturelementen die aus der Überbrückung einer gewellten Doppelschicht entstehen und sich dann zu Röhren aufrollen. Am deutlichsten sieht man das beim violetten Phosphor, der sozusagen eine geordnetere Form des roten Phosphors ist:

Außerdem gibt es noch den Schwarzen Phosphor

und ein paar weitere exotische Modifikationen.
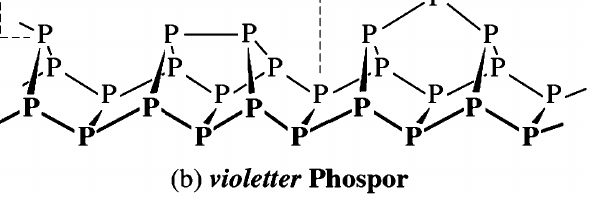
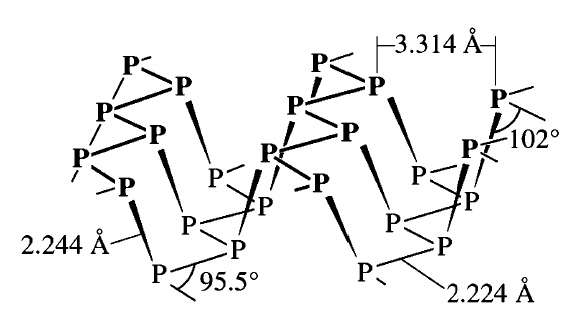
Ich sehe keine Ähnlichkeiten zur richtigen Struktur. Bei Dir scheint die irgendwie kubisch zu sein, also in Quadraten mit 90°-Winkeln, und so etwas gibt es in der echten Struktur nicht.
Mein Fehler 👌dachte die Bindung wäre kristalliner. Weißt du wie man anhand der Struktur erklären kann warum roter Phosphor stabiler als weißer ist ?
Phosphor bevorzugt einen Bindungswinkel von ca. 90° zwischen seinen Bindungen. Im Roten oder Schwarzen Phosphor ist das möglich, aber im weißen Phosphor erzwingt die tetraedrische Struktur natürlich 60°-Winkel, und damit ist der Phosphor unglücklich.
Danke. Die Skizze zum roten Phosphor soll einfach nur aussagen das die Bindung kristallin ist. Ich mache die Präsentation auf Mittelstufen Gymnasialnivau und stelle das vereinfacht da. Weißt du ob diese Struktur das roten Phosphor grundsätzlich richtig ist ?