Könnte mir jemand diese zwei Zusammenhänge erklären?
Welche Ionen sind imersten Satz überhaupt gemeint, und weshalb ist der SN1 Mechanismus in dem Fall wahrscheinlocher? Was ist gemeint mit, je höher das Carbenium-Ion substituiert ist? Es müssen doch nach Trennung der Abgangsgruppe immer drei weitere Substituenten, z.b. Alkylgruppen, gebunden sein? Ist gemeint, ob das Carbeniumion primär, sekundär oder tertiär ist?
LG

1 Antwort
Welche Ionen sind imersten Satz überhaupt gemeint
Mit Ionen sind im Text die Carbeniumionen gemeint. Carbeniumionen sind dreifach koordinierte Carbokationen. "Koordiniert" gibt die Anzahl der benachbarten Atome an. Carbokationen sind allgemein Ionen mit einem positiv geladenen Kohlenstoff.
Was ist gemeint mit, je höher das Carbenium-Ion substituiert ist?
Ein Substituent ist ein Rest, der ein Wasserstoff-Atom ersetzt. In diesem Kontext Alkylgruppen. Es gibt primäre (ein Substituent), sekundäre (zwei Substituenten) und tertiäre (drei Substituenten) Carbeniumionen. Ein "hoher Substitutionsgrad" meint viele Substituenten (im Falle des Carbeniumions also 3).
Es müssen doch nach Trennung der Abgangsgruppe immer drei weitere Substituenten, z.b. Alkylgruppen, gebunden sein?
Nein, das muss nicht sein. Bei einem sekundären Carbeniumion wären z. B. nur 2 Substituenten vorhanden.
und weshalb ist der SN1 Mechanismus in dem Fall wahrscheinlocher?
Bei einer nukleophilen Substitution wird eine Abgangsgruppe durch das Nucleophil ersetzt. Das ist die Gesamtreaktion:
"N1" bedeutet, dass es sich um eine Reaktion 1. Ordnung handelt. D.h. die Geschwindigkeit der Reaktion ist von der Konzentration von R-X abhängig und unabhängig von der Konzentration des Nucleophils. Der geschwindigkeitsbestimmende Schritt ist immer der langsamste Schritt und hier ist es die Bildung eines Carbeniumions unter Freisetzung der Abgangsgruppe (erst danach greift das Nucleophil an):
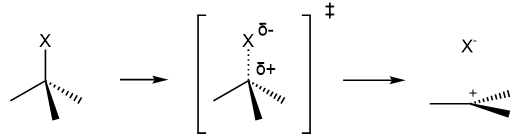
Diese Reaktion erfolgt über den Durchlauf eines Übergangszustandes, bei welchem die Abgangsgruppe sich im Begriff des Abspaltens befindet:

Bereits hier liegt eine Partialladung auf dem Kohlenstoff. Der Übergangszustand und das Carbeniumion sind sich energetisch und strukturell ähnlich. D. h. Faktoren die zur Stabilisierung des Carbeniumions führen, wie ein hoher Substitutionsgrad oder ein geeignetes Lösemittel stabilisieren auch den Übergangszustand, senken ihn also energetisch herab. Dadurch sinkt die Aktivierungsenergie und eine geringe Aktivierungsenergie drückt sich in einer höheren Reaktionsgeschwindigkeit aus.