Räumliche Struktur Ethan?
Welche räumliche Struktur (also: linear, trigonal-planar, gewinkelt, etc) hat Ethan (C2H6)?

2 Antworten
Die Kohlenstoffatome sind sp3-hybridisiert, d.h. die Bindungen gehen tetraedrisch vom Kohlenstoff aus (alle Bindungswinkel betragen 109,5 Grad). Die C-H-Bindung misst 1,09 Ångström und die C-C-Bindung 1,54 Ångström. Um die C-C-Bindung ist freie Drehbarkeit möglich, weswegen Ethan in verschiedenen Konformationen auftreten kann. Am energetisch ungünstigsten ist die ekliptische Konformation, bei welcher der Dieder-Winkel, d.h. der Winkel zwischen zwei durch die jeweiligen C-C-H-Bindungen aufgespannten Ebenen beider Kohlenstoff-Atome 0, 120 oder 240 Grad beträgt. Stellt man das Ethan-Molekül in der Newman-Projektion dar (die Betrachtung erfolgt hier genau entlang der C-C-Bindung), so verdecken die Wasserstoff-Atome im Vordergrund die Wasserstoff-Atome im Hintergrund:

Am energetisch günstigsten ist die gestaffelte Konformation, bei welcher der Dieder-Winkel 60, 180 oder 300 Grad beträgt. In der Newman-Projektion liegen die hinteren Wasserstoff-Atome dann genau zwischen den vorderen Wasserstoff-Atomen:

Zwischen diesen Extrema existieren alle möglichen Zustände.
Hier einmal Ethan in der gestaffelten Konformation von der Seite gezeigt:

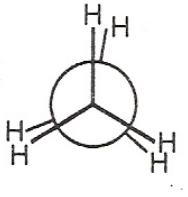
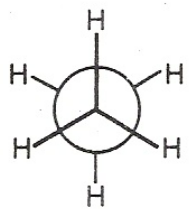
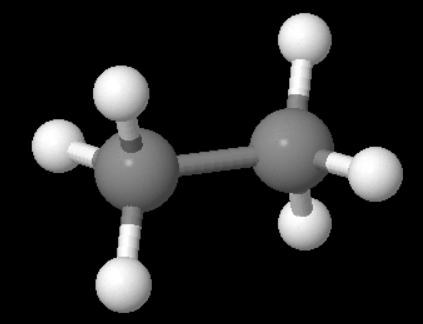
Jedes der beiden Kohlenstoffatome hat eine tetraedrische Grundstruktur mit 109,5° Bindungswinkel.
Daraus ergibt sich, dass die in deinem Bild gerade dargestellte H-C-C-H - Linie in Wirklichkeit als eine Zickzack-Linie verläuft.
Hilft dir das weiter?😊
VG