BH3 Außenelektronen?
Hallo,
B hat ja drei Außenelktronen und würde mit h3 einen trigonal planare struktur einnehmen. Müsste bor aber nicht eine volle Außenschale erhalten, wieso klappt es bei trigonal planaren Gestalten trotzdem, dass nur 3 Doppelbindungen eingegangen werden? Danke im Voraus
2 Antworten
Moin,
Borane (so heißen diese Dinger) sind Moleküle, in denen das Boratom eigentlich eine Elektronenlücke aufweist.
Deshalb müssen solche Moleküle zu „Tricks” greifen, um die Elektronenlücke zu schließen.
Beim Bortrichlorid können das die freien (nicht-bindenden) Elektronenpaare der Chloratome übernehmen.
Aber das geht beim Wasserstoff als Bindungspartner natürlich nicht, denn das Wasserstoffatom hat keine freien Elektronenpaare.
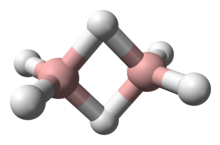
Deshalb bilden sich sogenannte Dimere, also die Kombination von zwei Molekülen:

Im Grunde 2 x BH3 = B2H6.
Die mittelständigen Wasserstoffatome gehören mal zum einen, mal zum anderen Boratom. Die Bindungselektronen sind völlig delokalisiert, das heißt, du kannst sie weder dem einen noch dem anderen Atom klar zuordnen.
Das füllt unter dem Strich die Elektronenlücke anteilig auf. Aber das ist auch der Grund, warum du zwar einzelne Borchlorid-Moleküle, aber keine einzelnen Borhydrid-Moleküle isolieren kannst.
Bor und seine Verbindungen ist eine Sache für sich...
LG von der Waterkant
Im BH₃ gibt es drei B–H-Bindungen, und wie Du richtig bemerkt hast, kann das Bor dabei nur ein Elektronensextett erreichen. Ihm fehlt also ein Elektronenpaar, und deshalb steht es unter Druck, sich etwas einfallen zu lassen.
Die Lösung besteht in Dimerisierung 2 BH₃ ⟶ B₂H₆ Jetzt wirst Du vielleicht fragen, wie die chemische Bindung im Diboran funktioniert. Die Antwort ist kompliziert; es liegen nämlich Zwei-Elektronen-Drei-Zentrenbindungen vor, also bindet ein Elektronenpaar atypischerweise drei Atome aneinander, in diesem Fall die Atome B–H–B. Wir haben es hier mit „zweibindigem“ Wasserstoff zu tun, und das sind keine H-Brücken, sondern etwas ganz anderes.
Die Bindungen im Diboran sind zwar exotisch, aber beachtlich stabil. BH₃ ist deshalb nur bei extrem geringem Druck stabil, unter realistischen Bedingungen dimerisiert es vollständig.