Strukturformel Chlormonoxid?
Hallo zusammen,
ich muss in meine Präsentation für Chemie (Klasse 9) die Strukturformel von Chlormonoxid einbeziehen. Ich weiß, dass es ein Radikal ist, also ein ungepaartes Valenzelektron hat. Doch im Internet gibt es sehr viele verschiedene Grafiken dazu, hier ein Beispiel:

Das macht am meisten Sinn, oder? Aber so ganz blicke ich nicht durch!
Wäre nett, wenn mir ein Experte weiterhelfen könnte... 😁
VG
2 Antworten
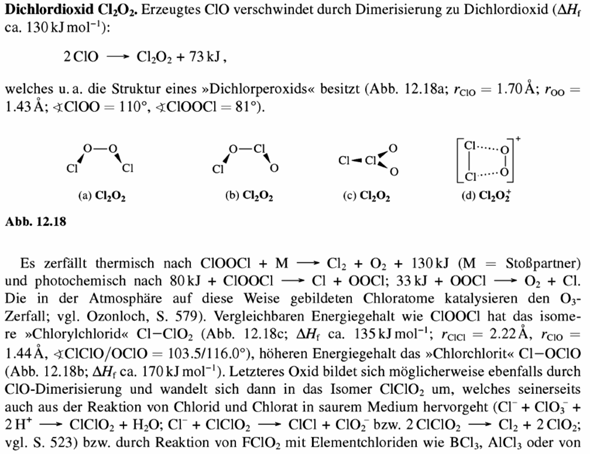
Grundsätzlich kann man das radikalische Elektron entweder am Chlor oder am Sauerstoff unterbringen. Wo es im Molekül wirklich sitzt, traue ich mich nicht vorauszusagen (ESR-Spektroskopie könne helfen, aber vermutlich ist das Radikal nicht stabil genug); aber aus dem Bauch heraus würde ich sagen am Sauerstoff, da ClO zu einem Dichlorperoxid ClOOCl dimerisiert. Andererseits kann das radikalische Elektron durchaus auch über beide Atome verteilt sein, und dann ist es beliebig, welche Formel Du schreibst.
Der Holleman-Wiberg schreibt dazu nur:

Allerdings gibt es vom Dimersierungsprodukt Cl₂O₂ insgesamt drei Isomere, und die Struktur ClOClO („Chlorchlorit“) scheint auch moderat stabil zu sein.


Für mich passt das. Was sagt das Internet denn außerdem? Etwas anderes kann ich mir spontan gar nicht vorstellen?
Ich denke, dass einfach die Suchmaschine ähnliche Bilder angezeigt hat, die eben nur ähnlich waren. Denn für Chlormonoxid gibt es nicht so viele Bilder im Internet...
Da gab es noch Darstellungen, wo z. B. der Strich ganz rechts am Chlor gefehlt hat, oder sogar ganz verrücktes Zeug mit 2 Sauerstoffatomen usw.
Vielen Dank für die Antwort!