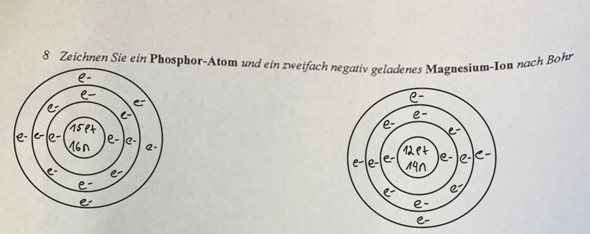
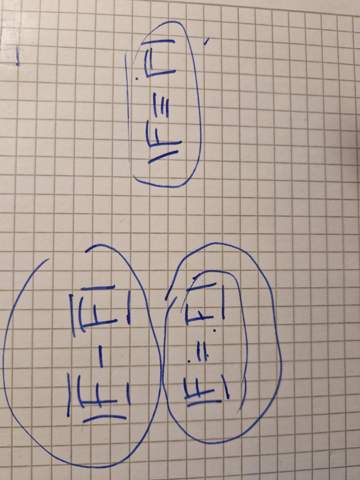
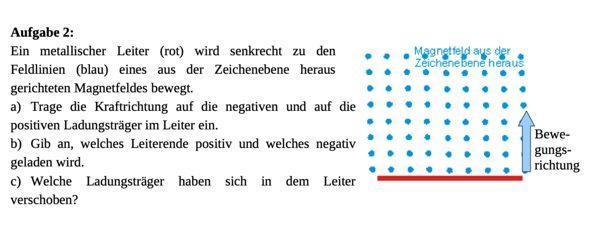
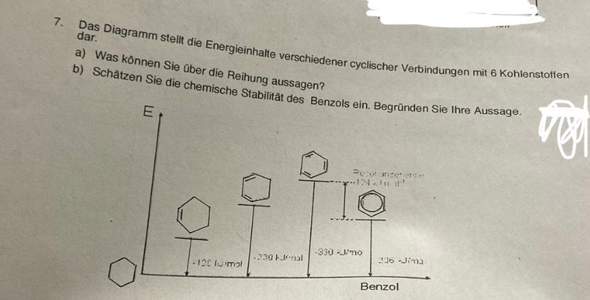
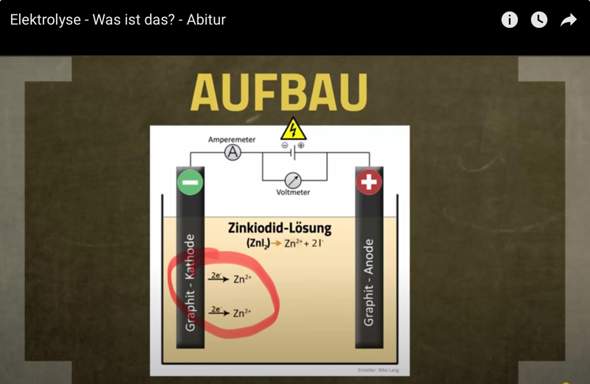
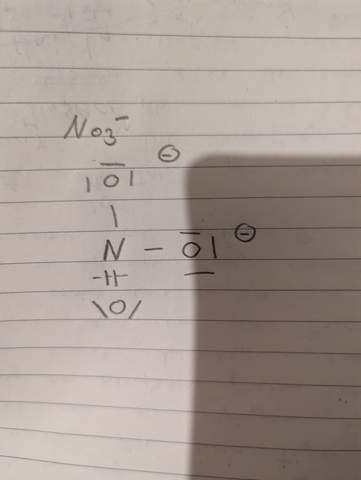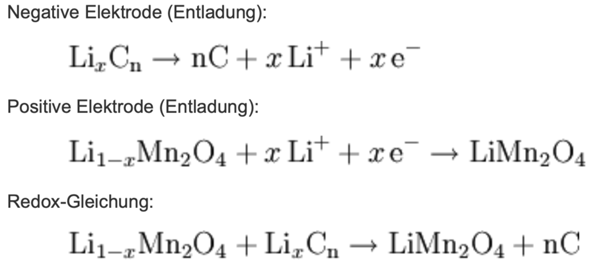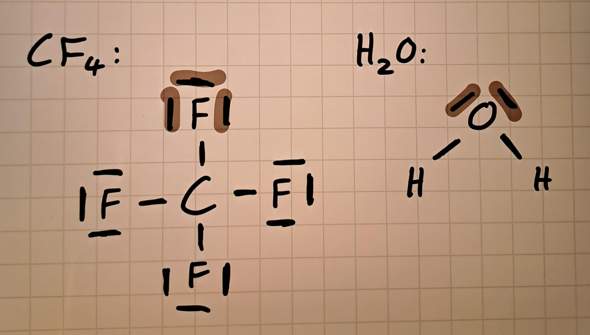Hallo sind die Antworten zu den Aufgaben so richtig?
aufgabe a)= Die Anordnung der ringförmigen Verbindungen mit Kohlenstoffatomen in diesem Diagramm zeigt eine deutliche Abfolge in Bezug auf ihre Energieinhalte. Beginnend mit dem ersten Ring, der eine einzige ungesättigte Bindung aufweist, steigen die Energieinhalte schrittweise mit der Anzahl der ungesättigten Bindungen in den folgenden Ringen.
Der zweite Ring, gekennzeichnet durch zwei ungesättigte Bindungen, liegt energetisch höher als der erste Ring. Gleiches trifft auf den dritten Ring mit drei ungesättigten Bindungen zu - er weist einen noch höheren Energiegehalt auf als der zweite.
Allerdings stellt der vierte Ring, der sogenannte "Kreis" oder Benzolring, eine interessante Abweichung dar. Obwohl erwartet wurde, dass seine Energie höher als die der drei vorherigen Ringe sein würde, liegt der Benzolring tatsächlich energetisch unter dem Ring mit zwei ungesättigten Bindungen. Das ist bemerkenswert und wirft Licht auf die spezielle Stabilität des Benzolrings.
Diese Anomalie wird durch die Elektronenstruktur des Benzolmoleküls erklärt. Der Benzolring weist eine spezielle Delokalisierung von Elektronen auf, die zu einer Mesomeriestabilisierung führt. Diese Delokalisierung der Elektronen verringert den Gesamtenergieinhalt des Moleküls im Vergleich zu Molekülen mit fixierten Doppelbindungen.
Daher zeigt die Reihenfolge der ringförmigen Verbindungen mit Kohlenstoffatomen in diesem Diagramm nicht nur eine Zunahme der Energie mit steigender Anzahl ungesättigter Bindungen, sondern illustriert auch die besondere Stabilität des Benzolrings aufgrund seiner Elektronenstruktur.
könnte ich Aufgabe b) so beantworten? = Die chemische Stabilität des Benzols hängt von seiner einzigartigen Struktur ab. Benzol hat sechs Kohlenstoffatome, die in einem Ring angeordnet sind. Die besondere Sache an Benzol ist, dass es sechs Elektronen hat, die sich nicht an bestimmten Stellen im Molekül befinden, sondern über den gesamten Ring verteilt sind. Diese Elektronen sind irgendwie "frei", sie gehören nicht zu einer bestimmten Doppelbindung, sondern bewegen sich wie in einer Wolke über den Ring. Das nennt man delokalisierte Elektronen.
Diese Art der Elektronenverteilung macht Benzol stabil. Es ist nicht so reaktiv wie andere Moleküle mit Doppelbindungen. Diese Stabilität kommt von der "Aromatizität" des Benzols, also seiner aromatischen Natur. Das bedeutet nicht, dass es gut riecht – das ist nur ein historischer Name. Aromatische Moleküle wie Benzol haben eine bestimmte symmetrische Elektronenverteilung, die ihnen Stabilität verleiht.
Wenn man sich Benzol im Vergleich zu anderen Molekülen anschaut, die mehr Doppelbindungen haben, zeigt sich, dass Benzol eine niedrigere Energie hat. Das bedeutet, dass Benzol stabiler ist als diese hypothetischen Moleküle mit mehr Doppelbindungen. Diese Stabilität kommt von der besonderen Elektronenverteilung im Benzol.
Kurz gesagt: Die Elektronen im Benzol sind anders verteilt als in anderen Molekülen, was Benzol stabil macht und ihm seine speziellen chemischen Eigenschaften verleiht.