Wie kann N mit O eine Doppelbindungen haben?
Bei dem Molekül No3-
Sind alle einfachbesetzten Elektronen " voll" wenn man sie mit drei mal O verbindet , weil N also Stickstoff auch drei einfachbesetzte hat .
Wie kann es also sein dass es eine Doppelbindungen gibt ?
Und warum hat Sauerstoff 3 freie Elektronen , es ist doch in der 6. Hauptgruppe also muss es zwei freie Elektronen haben
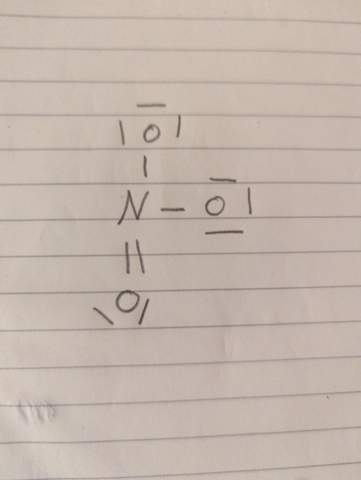
(Bild)
1 Antwort
Du meinst sicher das Nitrat-Ion.
In der zweiten Periode gilt die Oktettregel STRENG. Das bedeutet, daß kein Atom mit mehr als vier Elektronenpaaren ausgestasttet sein darf.
Beginne jetzt, eine Lewis-Formel zu zeichnen, indem Du nur die Einfachbindungen zwishen den Atomen einträgst. Das N-Atom ist mit drei O-Atomen verbunden. Jetzt zeichne vom N-Atom eine Doppelbindung zu einem N-Atom, das noch zwei freie Elektronenpaare bekommt. Die beiden anderen O-Atome bekommen je drei freie Elektronenpaare und eine negative Formalladung. Das N-Atom bekommt eine positive Formalladung. Da dies nur eine mesomere Grenzstruktur ist kannst Du sie mit der Doppelbindung zu jedem anderen O-Atom auch zeichnen. Der "wahre" Zustand ist die Überlagerung dieser drei Grenzstrukturen und real sind alle N-O-Bindungen gleich lang.
Nimm zuerst das "große Lasso" und umfange für jedes Atom alle Elektronenpaare, die mit ihm zu tun haben. Du zählst jeweils vier Paare, also acht Elektronen, was die Oktettregel erfüllt. Dann nimmst Du das "Kleine Lasso" und halbierst die bindenden Elektronenpaare. Du zählst für das "erste" Sauerstoffatom sechs Elektronen, wie es der Gruppe im PSE entspricht und keine "Ausgleichsladung" erfordert. Die beiden anderen O-Atome haben jeweils sieben Elektronen, tragen also eine negarive Ladung. Das N-Atom hat ein Elektron weniger, als in seiner Gruppe üblich, es trägt also eine positive Ladung. In Summe (zwei negative und eine positive Formal-Ladung) ergibt sich die nach Außen messbare einfach negative Ladung. Da Stickstoff elektropositiver ist als Sauerstoff brauchen wir uns keine Gedanken über dierse Ladungsverteilung zu machen. Die Sauerstoffatome ziehen stärker an den Elektronenpaaren.
Kannst Du mir deine Lewis-Formel zeigen, in der ein Sauerstoffatom im Nitration drei freie Elektronenpaare hat?
Zum Verständnis ist eine klare Sprache unbedingt notwendig. Wir unterscheiden hier streng zwischen freien Elektronen, in Lewisformeln durch Punkte eingezeichnet, und Elektronenpaaren, durch Striche symbolisiert.
Mal etwas anders drauf geschaut: Das Stickstoffatom bindet sich zunächst mit seinen drei freien Elektronen an jeweils ein Sauerstoffatom. Die haben in diesem Denkschritt jeweils noch ein freies Elektron "übrig" und das Stickstoffatom hat noch ein freies Elektronenpaar übrig. Dazu kommt noch ein überschüssiges Elektron aus der Geasamtladung des Ions.
Jetzt kommt das "Elektronenhopping", das die freien Elektronen umverteilt. Das Einfachste ist, das "Überschußelektron" unterzubringen. Es paart sich mit dem letzten freien Elektron an einem O-Atom und gibt dem Ganzen eine (messbare) negative Ladung. Wenn jetzt eines der anderen Sauerstoffarome sein freies Elektron dem Anderen "sponsort" und dafür sich vom Stickstoff das freie Elektronenpaar in einer Pi-Bindung "leiht", dann kommen wir zu dem von mir erklärten Verteilungsmuster.
Da die Elektronen sich im Molekül sehr schnell bewegen kann man jedem der Sauerstoffatome auch 2/3 einer negativen Ladung und ein Drittel der Doppelbindung zuschreiben, während am Stickstoffatom die positive Ladung "haften" bleibt.
Ich hab due Lewis formel ergänzt . Also unter freie Elektronen verstehe ich ja Die Elektronen , die schon zweifach besetzt sind sich also nicht mehr binden können . Und zu deiner Antwort : Ich verstehe den 1.Schritt schon nicht , weil Sauerstoff hat ja zwei einfach besetzte elektronen , ich kann es also nicht dreimal mit N verbinden weil es ja nur einmal N gibt und N nur drei einfachbesetzte hat