Chemie Orbitale Aromaten/Benzol?
Hallo sind die Antworten zu den Aufgaben so richtig?
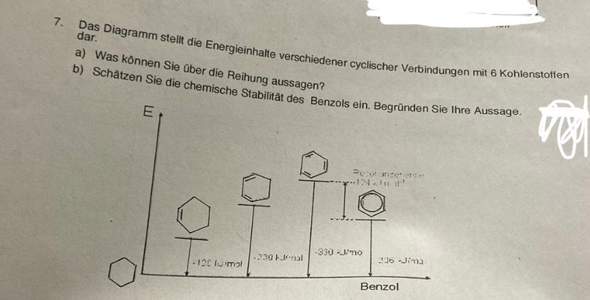
aufgabe a)= Die Anordnung der ringförmigen Verbindungen mit Kohlenstoffatomen in diesem Diagramm zeigt eine deutliche Abfolge in Bezug auf ihre Energieinhalte. Beginnend mit dem ersten Ring, der eine einzige ungesättigte Bindung aufweist, steigen die Energieinhalte schrittweise mit der Anzahl der ungesättigten Bindungen in den folgenden Ringen.
Der zweite Ring, gekennzeichnet durch zwei ungesättigte Bindungen, liegt energetisch höher als der erste Ring. Gleiches trifft auf den dritten Ring mit drei ungesättigten Bindungen zu - er weist einen noch höheren Energiegehalt auf als der zweite.
Allerdings stellt der vierte Ring, der sogenannte "Kreis" oder Benzolring, eine interessante Abweichung dar. Obwohl erwartet wurde, dass seine Energie höher als die der drei vorherigen Ringe sein würde, liegt der Benzolring tatsächlich energetisch unter dem Ring mit zwei ungesättigten Bindungen. Das ist bemerkenswert und wirft Licht auf die spezielle Stabilität des Benzolrings.
Diese Anomalie wird durch die Elektronenstruktur des Benzolmoleküls erklärt. Der Benzolring weist eine spezielle Delokalisierung von Elektronen auf, die zu einer Mesomeriestabilisierung führt. Diese Delokalisierung der Elektronen verringert den Gesamtenergieinhalt des Moleküls im Vergleich zu Molekülen mit fixierten Doppelbindungen.
Daher zeigt die Reihenfolge der ringförmigen Verbindungen mit Kohlenstoffatomen in diesem Diagramm nicht nur eine Zunahme der Energie mit steigender Anzahl ungesättigter Bindungen, sondern illustriert auch die besondere Stabilität des Benzolrings aufgrund seiner Elektronenstruktur.
könnte ich Aufgabe b) so beantworten? = Die chemische Stabilität des Benzols hängt von seiner einzigartigen Struktur ab. Benzol hat sechs Kohlenstoffatome, die in einem Ring angeordnet sind. Die besondere Sache an Benzol ist, dass es sechs Elektronen hat, die sich nicht an bestimmten Stellen im Molekül befinden, sondern über den gesamten Ring verteilt sind. Diese Elektronen sind irgendwie "frei", sie gehören nicht zu einer bestimmten Doppelbindung, sondern bewegen sich wie in einer Wolke über den Ring. Das nennt man delokalisierte Elektronen.
Diese Art der Elektronenverteilung macht Benzol stabil. Es ist nicht so reaktiv wie andere Moleküle mit Doppelbindungen. Diese Stabilität kommt von der "Aromatizität" des Benzols, also seiner aromatischen Natur. Das bedeutet nicht, dass es gut riecht – das ist nur ein historischer Name. Aromatische Moleküle wie Benzol haben eine bestimmte symmetrische Elektronenverteilung, die ihnen Stabilität verleiht.
Wenn man sich Benzol im Vergleich zu anderen Molekülen anschaut, die mehr Doppelbindungen haben, zeigt sich, dass Benzol eine niedrigere Energie hat. Das bedeutet, dass Benzol stabiler ist als diese hypothetischen Moleküle mit mehr Doppelbindungen. Diese Stabilität kommt von der besonderen Elektronenverteilung im Benzol.
Kurz gesagt: Die Elektronen im Benzol sind anders verteilt als in anderen Molekülen, was Benzol stabil macht und ihm seine speziellen chemischen Eigenschaften verleiht.
2 Antworten

Die "Bildungsenthalpien" (Energien) werden mit der des Cyclohexan (links unten) verglichen.
Cyclohexen mit 1 Doppelbindung liegt - wie zu erwarten - höher als die entsprechende gesättigte Verbindung.
Dann folgt Cyclohexa-(1,3)-dien (2 Doppelbindungen) - wieder wie erwartet.
Die nächste Verbindung in der Reihe wäre Cyclohexa-(1,3,5)-trien. Da diese Verbindung so nicht existiert, muss die Energie berechnet worden sein ("Extrapolation" aus den Energien der ersten 3 Verbindungen).
In dieser Verbindung kann man Einzel- und Doppelbindungen vertauschen und erhält dieselbe Verbindung (gedreht oder gespiegelt).
Wie oft in solchen Fällen, sind auch Zwischenzustände möglich. Das nennt man Mesomerie. (Da drin steckt "mesos" = "Mitte", für "dazwischen".) Man kann davon ausgehen, dass solche Zwischenzustände niedrigere Energie haben als jeder der "Grenzzustände". Das sieht man hier daran, dass Benzol auf einem niedrigeren Energieniveau liegt als die hypothetische Verbindung mit den 3 Doppelbindungen.
b): Wie hängen Bildungsenergien mit Stabilität zusammen?

Hallo und danke nochmal, könnte ich Aufgabe b) so beantworten?
: Die chemische Stabilität des Benzols hängt von seiner einzigartigen Struktur ab. Benzol hat sechs Kohlenstoffatome, die in einem Ring angeordnet sind. Die besondere Sache an Benzol ist, dass es sechs Elektronen hat, die sich nicht an bestimmten Stellen im Molekül befinden, sondern über den gesamten Ring verteilt sind. Diese Elektronen sind irgendwie "frei", sie gehören nicht zu einer bestimmten Doppelbindung, sondern bewegen sich wie in einer Wolke über den Ring. Das nennt man delokalisierte Elektronen.
Diese Art der Elektronenverteilung macht Benzol stabil. Es ist nicht so reaktiv wie andere Moleküle mit Doppelbindungen. Diese Stabilität kommt von der "Aromatizität" des Benzols, also seiner aromatischen Natur. Das bedeutet nicht, dass es gut riecht – das ist nur ein historischer Name. Aromatische Moleküle wie Benzol haben eine bestimmte symmetrische Elektronenverteilung, die ihnen Stabilität verleiht.
Wenn man sich Benzol im Vergleich zu anderen Molekülen anschaut, die mehr Doppelbindungen haben, zeigt sich, dass Benzol eine niedrigere Energie hat. Das bedeutet, dass Benzol stabiler ist als diese hypothetischen Moleküle mit mehr Doppelbindungen. Diese Stabilität kommt von der besonderen Elektronenverteilung im Benzol.
Kurz gesagt: Die Elektronen im Benzol sind anders verteilt als in anderen Molekülen, was Benzol stabil macht und ihm seine speziellen chemischen Eigenschaften verleiht.

Mit der ersten Doppelbindung steigt die Energie. Mit der zweiten Doppelbindung steigt die Energie weiter. Daher sollte man erwarten, dass die Energie mit der dritten Doppelbindung noch weiter steigt. Das ist die GEDACHTE und BERECHNETE vierte Verbindung.
Das hätte man in der Zeichnung schon besser rausstellen können, dass der Ring mit 3 Doppelbindungen fiktiv ist. In Echt existiert ein Ring, in dem die zusätzlichen 6 Elektronen über alle 6 C-Atome verteilt sind. Und die echte Energie ist die gemessene, die sogar etwas geringer ist als beim Ring mit 2 Doppelbindungen.
Geringere Energie, ich vermute es handelt sich um die Verbrennungsenergie, bedeutet höhere Stabilität.