Lewisschreibweise. Wie sieht sie bei Stickstoff+Sauerstoff aus?

Bei N stimmt die Oktettregel aber bei O hat es ja bei einer Dreifachbindung ein Elektron zu viel... ich komme einfach nicht drauf wie man das jetzt genau machen muss. Könnte mir eventl. jemand helfen??
2 Antworten
Beim NO versagt die Darstellung mit einer Lewisformel, wie übrigens auch beim Sauerstoff O₂ in der stabilen Triplett-Form mit 2 ungepaarten Elektronen.
Erklären kann die Bindungsverhältnisse nur das Molekülorbital-Modell (MO-Modell). In diesem gibt es keine freien Elektronenpaare, nur bindende und antibindende, also absoßende Elektronen.
Die relevanten 2p-Orbitale bilden im N₂ 3 bindende Elektronenpaare, also eine Dreifachbindung, im NO 3 bindende Paare und ein einzelnes antibindendes Elektron, was einer 2½fachbindung entspricht, und im O₂ 3 bindende Paare und 2 einzelne antibindende Elektronen, was einer Dopplbindung entspricht.
Wenn du nur Bahnhof verstehst, was wahrscheinlich ist, dann merke dir, dass sich einfach nicht jeder Stoff mit einer Lewisformel darstellen lässt.
Moin,
ja, ja, die Stickoxide... Ein Kapitel für sich.
In Lewisschreibweise wird das oft als „stabiles” Stickstoff-Radikal geschrieben, etwa so:
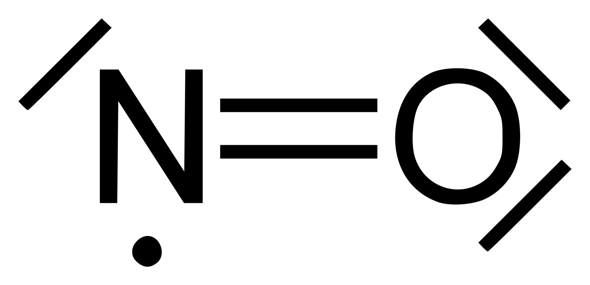
Manchmal findest du aber auch das hier:
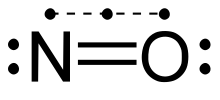
Letzteres zeigt vielleicht eher die „Wahrheit”. Aber so richtig unproblematisch ist keins von beiden, was aber nur einmal mehr zeigt, dass unsere Methoden der Darstellung realer Bindungsverhältnisse manchmal ihre Grenzen hat.
LG von der Waterkant
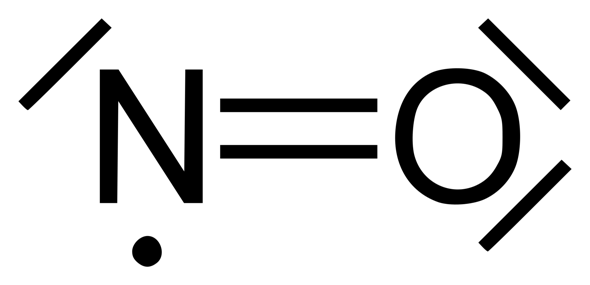
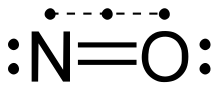
Bei der oberen Darstellung erfüllt Stickstoff die Oktettregel nicht. Es ist ein Radikal (mit ungepaartem Elektron). Deshalb ist in dieser Hinsicht die untere Darstellung ja auch etwas besser. Aber auch sie hat ihre Schwächen (so ist zum Beispiel die Elektronenaffinität des Sauerstoffs größer als die vom Stickstoff, was aber hier nicht zum Ausdruck kommt; oder was ist das für eine Bindung mit den drei Elektronen und der gestrichelten Linie?!).
Wie gesagt, unsere Ausdrucksformen für reale Bindungsverhältnisse stoßen manchmal an ihre Grenzen.
Aber habe trotzdem noch eine Frage beim oberen wie hat N 8 Valenzelektronen? Wie erfüllt N die Oktettregel? Wir müssen immer die Kreise zum kontrollieren der Oktettregel machen. Hier weiss ich leider nicht wie ich die beiden Kreise machen muss