(Chemie) Darstellung eines Moleküls im Vergleich?

Hilfe bei A3 bitte.

Wie wäre es mit selbst zeichnen und korrigieren lassen?

Ich weiß aber nicht ob ich die beiden Moleküle als eine chemische Verbindung aufschreiben sollte oder ob ich dass jeweils als einzelne Bindungen zeichnen soll.
1 Antwort

Hi,
ah, hier kommt die Antwort, was du mit "Struktur" meinst.
Bei der Summenformel schaust du, welches Verhältnis von Atomen überhaupt vorliegt. Die Formeln für Wasser und Ammoniak wirst du aber, denke ich, wissen.
Bei der Lewis-Strukturformel spielt die Raumgeometrie noch keine Rolle. Du schaust für jedes Atom, wie viele freie Elektronenpaare und wie viele Elektronen es hat, die jeweils eine Bindung eingehen können. Wasserstoff steht in der ersten Hauptgruppe, hat also nur ein einzelnes Elektron. Sauerstoff steht in der sechsten Hauptgruppe, hat also zwei freie Elektronenpaare und zwei einzelne Elektronen. Stickstoff (5. Hauptgruppe) hat ein freies Elektronenpaar und drei einzelne Elektronen. Aus den Summenformeln H2O und NH3 weißt du, dass jedes dieser dreien Elektronen mit je einem H-Atom eine Bindung eingeht. Da eine Bindung immer aus zwei Elektronen besteht, schreibt man einen Strich zwischen die Elementsymbole. Die freien Elektronenpaare nehmen besonders viel Platz weg, weshalb die H-Atome beim NH3 relativ gedrängt aussehen.
Das EPA-Modell ist ein Modell, dass die räumliche Struktur von Molekülen über Keilstriche darstellt. Dabei bedeutet ein ausgemalter Strich, dass die Bindung nach vorn zeigt (aus der Ebene nach vorn), eine gestrichelte Linie bedeutet, dass die Bindung nach hinten zeigt. Hier stellen wir das, was wir bei der Lewis-Formel in 2D gezeichnet haben, nun in 3D dar. Bei Wasser ist das kaum möglich, denn in der Theorie ist es ein Tetraeder, aber zu zwei der Ecken zeigen eben Elektronenpaare, keine Bindungen. Die Realstruktur ist somit eine gewinkelte Struktur. Der Tetraederwinkel zwischen den Wasserstoffatomen beträgt 104,5°. Bei Ammoniak beträgt er 107°; dort kannst du über die Keilstriche nun auch das Räumliche darstellen. Die Realstruktur bei Ammoniak ist trigonal pyramidal.
Das Kugelstabmodell ist gar nicht so weit von dem entfernt, was bei c) im EPA-Modell gezeichnet werden muss. Deine Atome sind eben Kugeln, die Bindungen sind Stäbe.
Das Kalottenmodell behält zwar im Wesentlichen die räumliche Struktur bei, stellt Atome allerdings als Kugeln dar, die sich direkt berühren. Hier wird die unterschiedliche Größe der Atome aber abgebildet.
Die Lösung ist also:
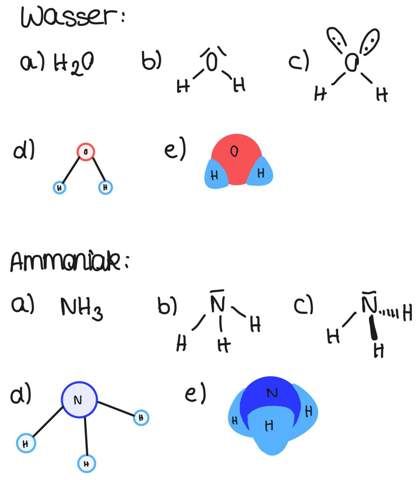
Bei c) für Ammoniak hätte ich das Elektronenpaar natürlich zeichnen können wie bei Wasser. Es würde dann gerade nach oben zeigen.
LG