Kann mir jemand bei diesen Aufgaben helfen?
Aufgaben:
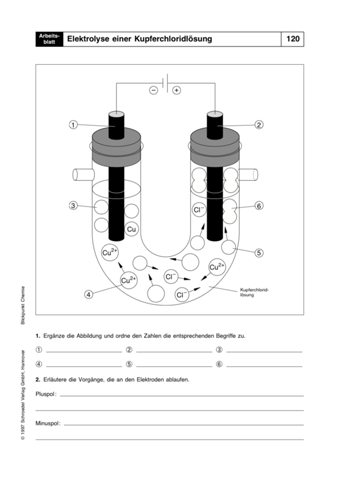
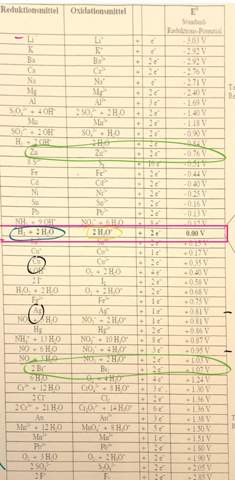
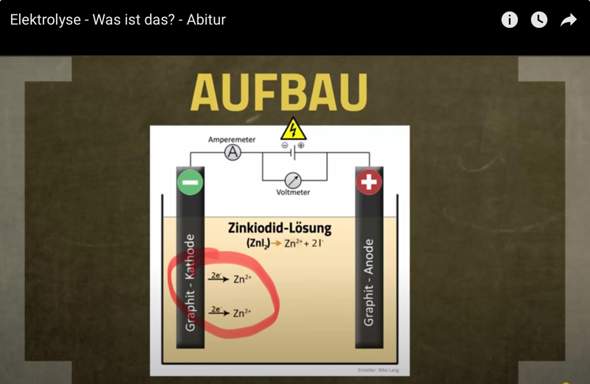
- Stellen Sie für die Elektrolyse des Wassers die Gesamtgleichung und die Teilgleichungen auf.
- Erklären Sie den Farbumschlag des Indikators. Erklären Sie unter Angabe von Re- aktionsgleichungen, welche Änderungen im Kathoden- und Anodenraum bezüglich der Ammonium- und Acetat-Ionen auftreten.
Material:
Versuch: Elektrolyse von Wasser in einer Ammoniumacetat-Lösung unter Zugabe von
Bromthymolblau
Materialien:
U-Rohr, Stativmaterial (oder die aus dem Unterricht bekannten Gefäße für Elektrolysen), 2 Kohleelektroden, 2 Kabel, Gleichspannungsquelle
Chemikalien: wässrige Ammoniumacetat-Lösung (aq) mit Indikatorlösung (Bromthymolblau) versetzt
Durchführung: Bauen Sie die Materialien für den Versuch auf und elektrolysieren Sie die Lösung für 5 –10 Minuten mit einer Spannung von 5 –10 Volt.
Beobachtung: Nach kurzer Zeit ist an beiden Elektroden eine Gasentwicklung zu beobachten. An der mit dem Minuspol der Gleichspannungsquelle verbundenen Elektrode A (Kathode) ist eine stärkere Gasentwicklung zu beobachten als an der mit dem Pluspol der Gleichspannungsquelle verbundenen Elektrode B (Anode). An der Kathode ist nach einiger Zeit eine deutliche Blaufärbung der ursprünglich grünen Lösung zu beobachten.An der Anode dagegen ist nach einiger Zeit eine deutliche Gelbfärbung der vorher grünen Lösung zu verzeichnen.
Hinweis: Bromthymolblau besitzt einen pKS-Wert von 6,8.