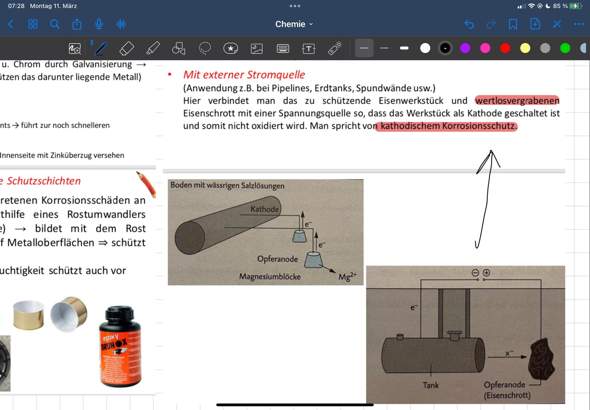
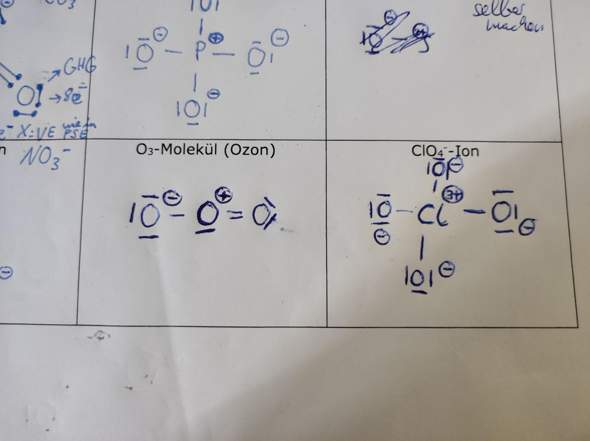
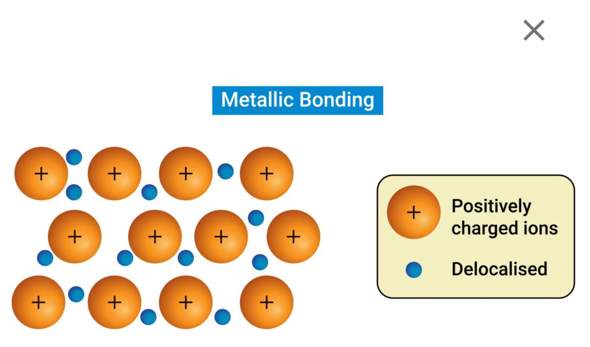
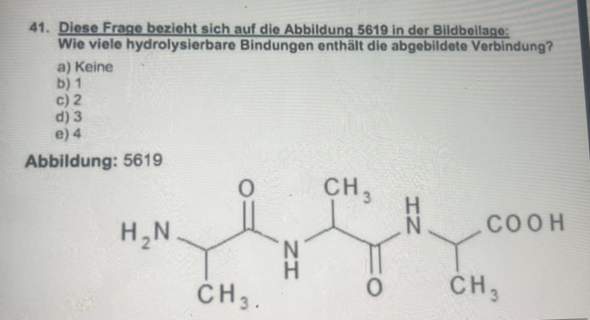
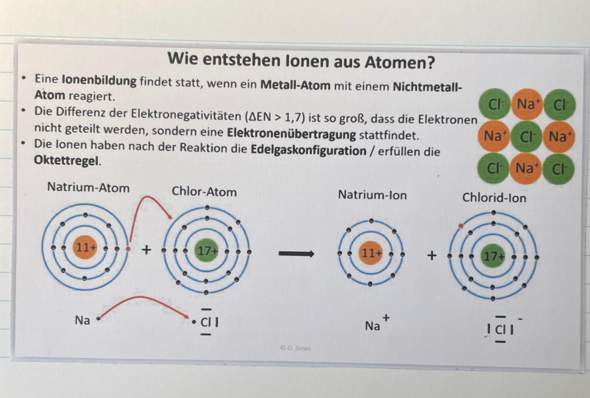
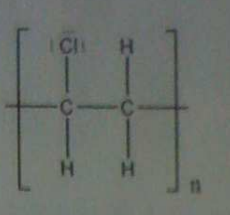
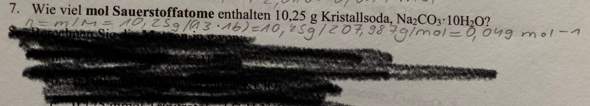Hallo, in der theoretischen Kernphysik wird die Bindungsenergie (pro Nukleon) nach einer Kernspaltung oder Kernfusion von Atomkernen ja niedriger weil die Differenz der Gesamtenergie von den zwei Ausgangskernen (in der Fusion) oder dem Ausgangskern (bei der Spaltung) und ihren Produkten ja immer größer wird (Das gilt nur wenn mehr Energie freigsetzt wird als aufgewendet).
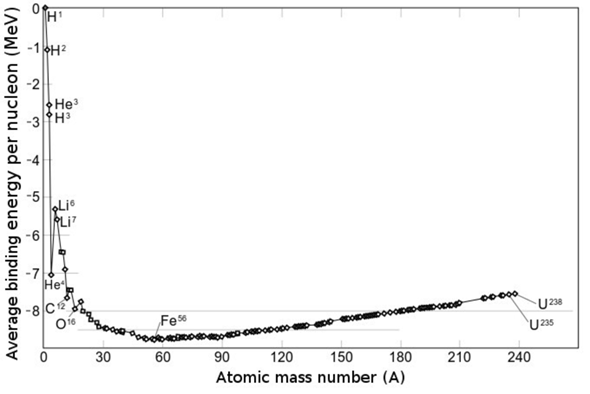
Das hier ist ein Graphen zu der Bindungsenergie in der theoretischen Kernphysik. (Die Bindungsenergie ist hier natürlich negativ weil es ja die Differenz der Gesamtenergie von den einzelnen Nukleonen und den Atomkernen zeigt.
In der praktischen Kernphysik ist die Bindungsenergie jetzt aber die Energie, die man benötigt um einen Atomkern in seine einzelnen Nukleonen zu zerlegen. Jedoch wird hierbei die Bindungsenergie nach einer Spaltung oder Fusion von Atomkernen höher.
Hier ist ein Graphen der die Bindungsenergie in der praktischen Kernphysik zeigt (Bindungsenergie wird mit Spaltung oder Fusion höher)
Ein Beispiel jetzt nochmal: Wenn wir jetzt z.B. bei der Kernfusion zwei Atomkerne verschmelzen dann könnte man ja sagen, dass die Bindungsenergie bei der Fusion freigesetzt wird (die Bindungsenergie wird niedriger, wie in der theoretischen Kernphysik). Dadurch wird die Stabilität der Atomkerne jedoch höher, weil die einzelnen Nukleonen ein günstigeres Energieverhältnis haben was wiederum heißt, dass die Bindungsenergie höher wird. (mehr Stabilität = mehr Energie benötigt um den Kern in die einzelnen Nukleonen zu zerlegen (praktische Kernphysik))
Damit heißt es ja, dass die Bindungsenergie höher und niedriger zugleich wird oder?
Wenn das so wäre, dann wäre ich sehr irritiert. Kann mich jemand aufklären?
Danke im Voraus!