Chemie Dipolcharakter?
Hi, kann mir jemand erklären, welche der Verbindungen den stärksten Dipolcharakter hat? Die folgenden Verbindungen: Methan, cis-1,2-diflourethen, trans-1,2-diflourethen, und 1,1,1,1-tetraflourmethan…
Ich glaube bei Tetraflourmethan ?? aber warum? wegen - Induktiven Effekt??
3 Antworten

Hi,
prinzipiell ist es sinnvoll, sich die Moleküle einmal aufzuzeichnen und nach VSEPR zu überlegen, welche Geometrie die Moleküle aufweisen. Im Anschluss bestimmst du alle polaren Bindungen und schaust, welches Atom partiell positiv und welches partiell negativ geladen ist (zum Vergrößern das Bild einfach anklicken):
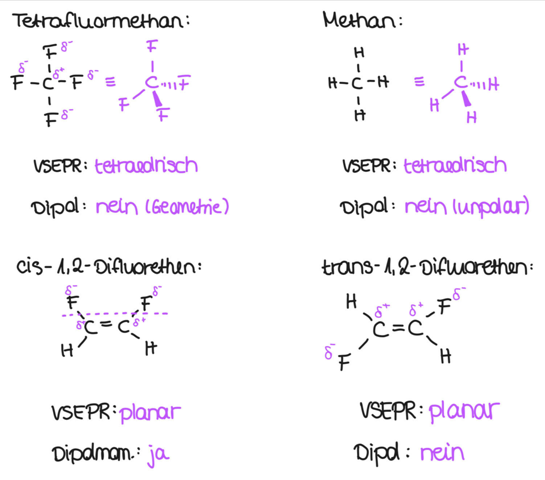
Du stellst sehr schnell fest, dass es etliche Faktoren gibt, die das Ausbilden eines Dipols bzw. das Vorhandensein eines Dipolmoments verhindern:
- Tetrafluormethan: Das Molekül ist nach VSEPR tetraedrisch. das heißt, das Kohlenstoffatom sitzt in der Mitte von Fluoratomen umgeben. Du kannst also keine gedankliche Achse durch das Molekül legen, die es in "zwei Pole" aufteilt. Das Dipolmoment ist hier also nonexistent.
- Methan: Auch hier hast du eine tetraedrische Struktur. Hinzu kommt allerdings, dass die Bindungen auch allesamt unpolar sind. Hier kannst du also ebenfalls kein Dipolmoment erwarten.
- trans-1,2-Difluorethen: Das Molekül ist zumindest mal planar durch die Doppelbindung. Die polaren C-F-Bindungen liegen sich aber gegenüber, sodass sich das mit den Dipolen wieder aufhebt (ähnlich wie bei CO2). Somit ist auch hier das Dipolmoment bei 0.
Bei cis-1,2-Difluorethen hast du beide polaren Bindungen auf einer Seite. Somit heben sich die Dipole nicht auf und du hast ein Dipolmoment. Das Molekül ist also das einzige, das überhaupt ein Dipolmoment aufweist, somit auch den stärksten Dipolcharakter haben muss.
LG
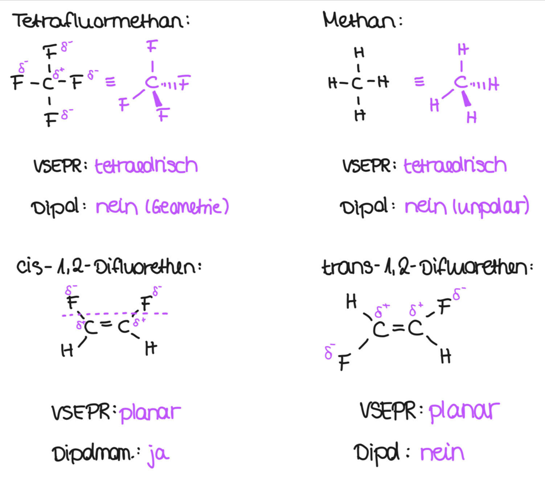

Also erstmal sind die 4 1er beim Tetrafluormethan sinnfrei. Wo sollen die Fluoratome sonst hängen, es gibt nur 1 C.
Dann hat Tetrafluormethan ein Dipolmoment von exakt 0, genauso wie Methan.
Es entscheidet sich also hier zwischen den beiden Difluorethenen. Und auch hier hat eines ein Dipolmoment von 0, weil sich die Dipolmomente der beiden polaren C-F Bindungen gegenseitig aufheben. Das ist beim trans Isomer der Fall. Das cis Isomer hat dagegen ein permanentes Dipolmoment.

Du bist ziemlich auf'm Holzweg. Erst mal schaust du dir Strukturen an, danach kannst du, falls erforderlich, mal Bindungen und Effekte näher betrachten.