induktive effekte Chemie?
Hallo
wieso wirken bei -C=O der -I-Effekt? Ich verstehe nicht genau, woher man weiß, wann es einen -I-Effekt oder +I-Effekt gibt
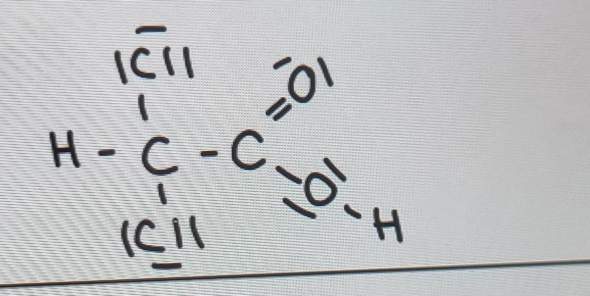
k
1 Antwort
Moin,
einen +I-Effekt haben eigentlich nur
- einfache Alkylreste (wie die Methylgruppe, die Ethylgruppe...; –R),
- verzweigte Alkylreste (wie die tert.Butylgruppe...; –C(CH3)3) oder
- ein Sauerstoffanion (–O–).
Die Carbonylgruppe (>C=O) hat einen –I-Effekt, weil das doppelt gebundene Sauerstoffatom eine größere Elektronegativität hat, so dass es zu einer Mesomeriestabilisierung kommt:
[>C=O ↔ >+C–O–]
Dadurch zieht auch der positivierte Carbonyl-Kohlenstoff die bindenden Elektronenpaare von seinen sonstigen Bindungspartnern weg.
Bei manchen Substituenten kann man die Wirkung des Effekts nachvollziehen bzw. erklären (wie zum Beispiel beim Carbonyl-Kohlenstoff). Bei anderen ist das nicht unmittelbar zu verstehen (wie zum Beispiel bei Alkylgruppen). Hier beruht das auf Erfahrungen bzw. auf Messungen von Reaktionsgeschwindigkeiten in bestimmter Weise substituierter Derivate.
Aber weil die Listen der gängigen +I-Effekt-Substituenten, des ±0-Effekt-Substituenten und der –I-Effekt-Substituenten nicht allzu lang sind, kann man die paar Substituenten auch einfach einmal auswendig lernen. Das wäre jedenfalls mein Tipp (weil du das dann so weißt, ohne alles verstehen zu müssen):
+I-Effekt:
- Alkylreste; –R
- verzweigte Alkylreste; –
- Sauerstoffanion
±0-Effekt:
- Wasserstoffatom
–I-Effekt:
- Hydroxygruppe; –OH
- Carbonylgruppe; [>C=O ↔ >C+–O–] ≡ [>C→O] (sowohl das Sauerstoffatom, als auch der Carbonyl-Kohlenstoff haben einen –I-Effekt)
- Carboxygruppe; –COOH
- Halogenatome; –F, –Cl, –Br, –I
- Nitrogruppe; –NO2
- Aminogruppe; –NH2
LG von der Waterkant
Du irrst dich. Kohlenstoff hat eine Elektronegativität von 2,5. Sauerstoff hat eine Elektronegativität von 3,5. Somit ist Sauerstoff der elektronegativere Bindungspartner oder anders gesagt: Sauerstoff hat die größere Elektronegativität (nicht umgekehrt).
Was dein Bild betrifft:
Die beiden Chloratome (–Cl) haben eine Elektronegativität von 3,1. Sie sind also ebenfalls elektronegativer als Kohlenstoff. Deshalb üben sie auf das C-Atom, an das sie gebunden sind, einen –I-Effekt aus.
Auch die Carboxygruppe (–COOH) übt auf dasselbe C-Atom, an das sie gebunden ist, einen –I-Effekt aus. Das liegt daran, dass der Carboxy-Kohlenstoff an zwei Sauerstoffe gebunden ist. Beide haben eine größere Elektronegativität als Kohlenstoff und ziehen folglich die bindenden Elektronenpaare vom Carboxy-C-Atom weg. Dadurch ist die Elektronendichte an diesem C-Atom gering, so dass es stark an dem bindenden Elektronenpaar zum nächsten C-Atom (an das auch die beiden Cl-Atome gebunden sind) zerrt. Darum hat die Carboxygruppe als Ganzes einen –I-Effekt.
Das C-Atom aus deinem Bild, an das zwei Cl-Atome und die Carboxygruppe gebunden sind, hat also drei –I-Effekt-Substituenten und folglich eine ziemlich geringe Elektronendichte. Daran ändert auch der vierte Bindungspartner, das Wasserstoffatom, nichts, denn sein I-Effekt ist ±0 (Wasserstoff hat mit einer Elektronegativität von 2,2 einen fast gleich großen Wert wie Kohlenstoff).
Wie du siehst, die Aussagen der geposteten Listen stimmen...
Alles klar?
Ich habe oben mal ein Bild hochgeladen. Wie sieht es da aus? C ist elektronegativer als O. Also dachte ich, dass es sich um den +I-Effekt handelt. Jedoch sieht man auch die Bindung zwischen C und CL. Da wäre es der -I-Effekt. Um welches von beiden handelt es sich jetzt genau?