Hilfe bei Chemie (Polare Atombindung?
Hi, ich brauche Hilfe bei folgenden Arbeitsblättern. Wenn jemand mit weiterhelfen kann, bitte antworten. Danke im Voraus.

2 Antworten
Hi!
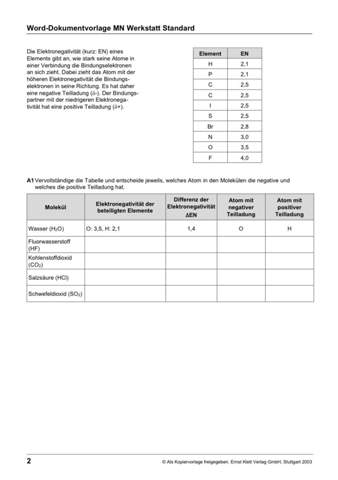
Zu Aufgabe A1:
Das Sauerstoffatom im Wassermolekül besitzt die höhere Elektronegativität (EN = 3,5), sodass es die Bindungselektronen der Wasserstoffatome (EN = 2,1) stärker an sich zieht. Die Elektronen sind also in Richtung des Sauerstoffatoms verschoben, so dass eine negative Teilladung am Sauerstoffatom und eine positive Teilladung am Wasserstoffatom entstehen. Da das Wassermolekül zwei unterschiedlich geladene Pole besitzt, nennt man es einen Dipol. Die Art der Bindung heißt polare Atombindung.
Zu Aufgabe A2: Schau dir mal die Struktur von Wasser genau an (siehe A1). Es handelt sich um einen Dipol: Auf der einen Seite der partiell negativ geladene Sauerstoff, auf der anderen Seite der partiell positiv geladenen Wasserstoff. Du hast also sozusagen zwei "Pole" mit unterschiedlicher Partialladung. Wenn du dort jetzt einen positiv aufgeladenen Stab ranhältst, so wirken Anziehungskräfte (negativ und positiv ziehen sich an) und deer Strahl wird abgelenkt.
Zu A1, Seite 2: Ich erkläre es dir an Fluorwasserstoff (HF, Verbindung 2). Die Verbindung besteht aus Fluor und Wasserstoff. Aus der Tabelle oben kannst du die Elektronegativitätswerte aufschreiben (H: 2,1; F: 4,0). Nun berechnest du die Differenz, indem du das kleinere vom größeren abziehst: ∆EN = 4,0-2,1 = 1,9. Das Element, das einen größeren Elektronegativitätswert hat, hat die negative Partialladung. Hier ist es Fluor, also hat das die negative Teilladung. Wasserstoff hat eine positive Teilladung.
Wenn du noch Fragen hast, dann melde dich.
LG
Stelle ein, was Du bisher an den Aufgaben selbst erledigt hast. Gerne schaue ich mir das dann an und korrigiere ggf.