Hallo erstmal,
ich hoffe, dass es hier vielleicht einige Chemie Experten gibt, die mir wegen folgender Situation weiterhelfen können:
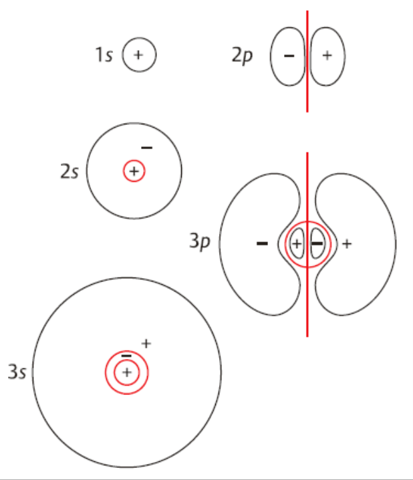
Ich nehme im Chemieunterricht gerade Atombindungen durch. Mein Lehrer hat uns diese mithilfe von Orbitalen erklärt, indem er uns sagte, dass die Valenzschale eines Atoms immer halb so viele Orbitale umfassen kann, wie es Elektronen gibt (sprich 4 Orbitale ab der K Schale), dass Orbitale erst einfach besetzt werden, dass sie nie mit mehr als 2 Elektronen besetzt sind und den größtmöglichsten Abstand zu einander haben wollen. Bei einem Orbital ist die Position also egal, bei zweien ist sie linear, bei dreien trigonalplanar und bei vieren tetraedrisch.
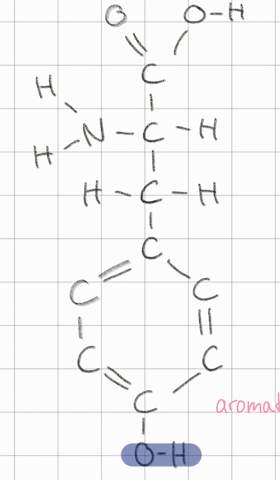
Zum Tetraeder hätte ich nun eine Frage. Wir hatten die Aufgabe ein Sauerstoffatom in Lewis-Schreibweise darzustellen. Dabei hat unser Lehrer uns erklärt, dass es absolut falsch sei, wenn die Striche (Elektronenpaare) bei dieser Schreibweise gegenüber liegend wären. Gegen den Uhrzeigersinn gelesen wäre also O Strich, Punkt, Strich, Punkt falsch und O Strich, Strich, Punkt, Punkt richtig. Ich verstehe nicht weshalb, mein Lehrer meinte, dass es am Tetraederwinkel liege, der unter dieser Vorraussetzung zwischen den einzelnen Elektronen nicht vorhanden wäre, wodurch es kein Tetraeder mehr wäre.
Aber weshalb? Beim Kohlenstoff zum Beispiel sind alle Orbitale einfach besetzt und werden zu jeder Seite in der Lewis Schreibweise um das C herum geschrieben. Dort ist es doch auch ein Tetraeder. Die Tatsache, dass es ein vollbesetztes Orbital an der Stelle eines einfach besetzten ist, ändert doch nichts an der räumlichen Form des Tetraeders(?). Warum also darf ich die Position der 2 Striche um das O beim Sauerstoff nicht beliebig festlegen, solange es wie beim C-Atom einem + um das O oder einem Kreuz (so bevorzugt es mein Lehrer) entspricht?
Ich hoffe wirklich meine Frage ist halbwegs verständlich und jemand hier kann es mir erklären:)
Danke!