π-Komplex & carbonium ion?

Ich verstehe nicht so ganz die Darstellungsweise, von links nach rechts:
1) Das Elektrophil wechselwirkt mit der Doppelbindung in dem Alken.
2) Es entsteht eine Koordinative Bindung (ich denke Mal, der Pfeil ausgehend von der Doppelbindung in Richtung des akzeptor soll das zeigen).
3) Warum wird hier jetzt plötzlich eine gestrichelte Bindung gezeigt? Was ist an dieser Bindung jetzt anders als bei der Koordinativen mit Pfeil Darstellung? Und wie unterscheidet sich das von der kovalenten Bindung, die mit einem durchgehenden strich dargestellt wird?
Ich verstehe auch nicht so ganz dieses "oder". Bezieht sich das darauf, dass es noch ein ungeklärtes, theoretisches Problem ist und man es einfach nicht genau weiss was von beiden entsteht oder kann wirklich je nach Bedingungen das eine oder andere kurzzeitig entstehen? Und wie trennt man die Art der Wechselwirkung von diesem π-Komplex und dem Carbonium Ion?
2 Antworten
Das "oder" in der Darstellung zeigt, dass es verschiedene mögliche Übergangszustände gibt, die je nach Reaktionsbedingungen entstehen können. Die verschiedenen Darstellungen zeigen einfach verschiedene mögliche Zustände in der Reaktion. Die genauen Details hängen oft von den spezifischen Bedingungen der Reaktion ab. :-)
Ich finde diese Abbildung ungeschickt, da hier verschiedene Modelle zusammengewürfelt werden. Grundsätzlich läuft eine solche zweistufige elektrophile Addition wie folgt ab:
- Das Elektrophil nähert sich dem Edukt an (bereits hier können Wechselwirkungen zwischen den Orbitalen der Bindung und dem Elektrophil auftreten (π-Komplex),
- es bildet sich eine Zwischenstufe
- und aus dieser schließlich das Produkt.
Das "oder" bezieht sich wohl darauf, dass der genaue Verlauf von der Reaktion abhängt. Die Wahl des Modells sollte zum beobachteten Produkt passen. Ein Beispiel: Brom reagiert mit einem Alken, hierbei könnten ein trans- und ein cis-Produkt gebildet werden, das trans-Produkt ist jedoch das Hauptprodukt. Warum? Ich habe den Mechanismus hier einmal skizziert:

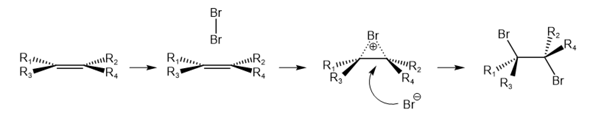
Zunächst nähert sich das Brommolekül der Doppelbindung an. Bereits hier existiert eine gerichtete Wechselwirkung zwischen dem π-Orbital und dem Brom und es findet eine Polarisierung des Brommoleküls statt. Infolgedessen wird das Brommolekül heterolytisch gespalten. Brom lagert sich an die Doppelbindung an und die positive Ladung ist über die gesamte Struktur verteilt (man spricht von einem Bromonium-Ion) und ein Bromid-Anion existiert nebenbei. Die Striche deuten an, dass es sich hier nicht um eine vollständige Bindung (Bindungsordnung = 1) zwischen den Atomen handelt. Das auf Ihrer Abbildung gezeigte Carbenium-Ion tritt hier praktisch nicht auf. Woran sieht man das? An der Produktselektivität: Im nächsten Schritt findet der nukleophile Angriff des Bromid-Anions statt. Das Molekül ist jedoch durch das bereits gebundene Brom auf dieser Seite abgeschirmt - es kann nur zu einem Rückseitenangriff kommen. Daher wird hier das trans-Produkt gebildet.
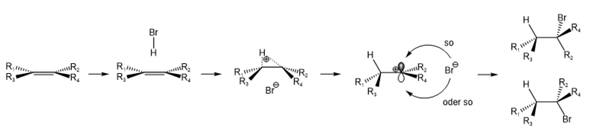
Anders ist das bei der Addition von Bromwasserstoff. Hier einmal skizziert:

Das Proton kann die positive Ladung deutlich schlechter stabilisieren, ein "Hydronium" wäre, falls überhaupt existent, also stark verzerrt. Hier bildet sich stattdessen ein Carbenium-Ion aus. Der Kohlenstoff mit der positiven Ladung ist sp2-hybridisiert (welches der beiden Kohlenstoffe die positive Ladung trägt, hängt von den Substituenten R ab). Sie können sich das Carbenium-Ion wie eine Scheibe vorstellen zu welcher senkrecht ein leeres p-Orbital steht. Der Angriff des Bromid-Anions kann nun von oben oder von unten erfolgen. Dies führt dazu, dass bei dieser Addition sowohl das cis- als auch das trans-Produkt entstehen kann.
Zur Referenz des Bildes:
Beyer-Walter Lehrbuch der Organischen Chemie, 24. Auflage, S.72
Oder werden bei einem π-Komplex die Elektronen nicht so deutlich delokalisiert wie beim Carbonium Ion?
Oder soll die Koordinative Pfeil Darstellung bloß den gerichteten Charakter verdeutlichen (Elektron Donator zu akzeptor)? Denn diese Information geht in der Darstellung vom Carbonium ion verloren.
Bei dem π-Komplex liegt eine koordinative Bindung vor. Die Bindung ist kovalent, aber beide Bindungselektronen stammen aus dem π-Orbital. Außerdem ist die Bindung gerichtet und zwar von der Doppelbindung zum Bromatom.
Bei dem Bromonium-Ion liegt ein dreigliedriger Ring vor, d.h. es existierten 2 Brom-Kohlenstoff-Bindungen. Da das π-System aber nur 2 Elektronen insgesamt zur Verfügung stellt, fehlen in den Bindungen Elektronen. Das deutet man durch die gepunkteten Linien an.
Hmm ok also:
Beim π-Komplex bleibt das π Orbital also erhalten und ist etwas Richtung X- verzerrt? (1x 3z-2e Bindung)?
Beim Carbonium wechselwirkt X- so stark, dass das π-Orbital "aufgerissen" (wie kann man das besser formulieren?) wird und jeweils 2x 2z-1e Bindungen entstehen?
Ich würde das nicht als "entweder π-Komplex oder Bromonium-Ion" gegenüberstellen. Das Bromonium-Ion (oder Carbenium-Ionen bei Mechanismen über offenkettige Zwischenstufen) sind reale Zwischenstufen innerhalb der zweistufigen Reaktion. Mit dem π-Komplex versucht man hingegen die Struktur zu beschreiben, wenn sich Alken und Elektrophil annähern. Das Alken und Brom begegnen sich in der Lösung, die Reaktion, d.h. die Spaltung des Brommoleküls und Anlagerung an die Doppelbindung ist noch nicht erfolgt, aber bereits jetzt existiert eine anziehende Wechselwirkung zwischen dem Alken und dem Br2-Molekül.
Beim π-Komplex bleibt das π Orbital also erhalten und ist etwas Richtung X- verzerrt? (1x 3z-2e Bindung)?
Ja, es bleibt erhalten, aber das ist keine Dreizentren-Bindung. Die Wechselwirkung besteht zwischen dem π-Orbital der Doppelbindung und dem Brom.
Beim Carbonium wechselwirkt X- so stark, dass das π-Orbital "aufgerissen" (wie kann man das besser formulieren?) wird und jeweils 2x 2z-1e Bindungen entstehen
Beim Bromonium-Ion ist es eher eine Dreizentren-Zweielektronen-Bindung (neben der σ-Bindung zwischen den Kohlenstoff-Atomen, die unverändert bleibt). Im Alken waren die p-Orbitale der sp2-hybridisierten Kohlenstoffatome parallel zueinander ausgerichtet, im Bromonium-Ion neigen sie sich zum Brom hin, die (C-C) π-Bindung nimmt ab, die (C-Br) σ-Bindungen nehmen zu.
Aus dem ersten Impuls heraus fühle ich, dass das mein Problem gelöst hat, danke! Ich muss es jetzt nur nochmal ein paar mal durchlesen zum nachzuvollziehen :-)
Ich hab hier eine Abbildung mit Orbital-"Lappen" für die Addition von Brom gefunden. Ansonsten kann es auch hilfreich sein die Reaktion schrittweise mit einem Molekülbaukasten durchzugehen.
Ja, es bleibt erhalten, aber das ist keine Dreizentren-Bindung. Die Wechselwirkung besteht zwischen dem π-Orbital der Doppelbindung und dem Brom.
--
Bei dem π-Komplex liegt eine koordinative Bindung vor. Die Bindung ist kovalent, aber beide Bindungselektronen stammen aus dem π-Orbital.
Kann man das denn dann überhaupt als Kovalente Bindung bezeichnen?
1. Zitierte Aussage hört sich eher danach an, als würde sich Pi system und X- erstmal leicht anziehen und wenn sie jetzt noch näher kommen sollten geht's über in die 3z-2e Bindung, die dann ganz schnell zum Carbenium Ion übergeht.
Bei der Darstellung im Beyer ist für mich nur das Problem, dass ich nicht interpretieren kann, was bitte eine Koordinative Bindung aus einem π-Orbital sein sollte..
Der Hollemann 102. Auflage sagt ganz klar, dass eine Koordinative Bindung im Grund nicht von einer Kovalenten Bindung unterschieden werden kann, in dem Fall hätten wir mit der Darstellung des π-Komplexes nichts anderes als die 3z-2e Bindung im Carbonium Ion ausgedrückt.
Außer natürlich, der Pfeil ausgehend von der Doppelbindung zu X- soll gar keine Koordinative Bindung darstellen, sondern eher eine abgeschwächte Variante.
Vielen Dank für die ausführliche Antwort :-)
Jetzt Frage ich mich nur noch, wo der Unterschied in der Natur von der "nicht-vollständige Bindung" in der kurzlebigen Darstellung mit gestrichelter Linie im carbonium Ion und die der Koordinativen Pfeil Darstellung des π-Komplexes liegt?