Chemie Lewisformel. Was tun bei + und -?
Hi ich verstehe nicht das mit dem + und -.
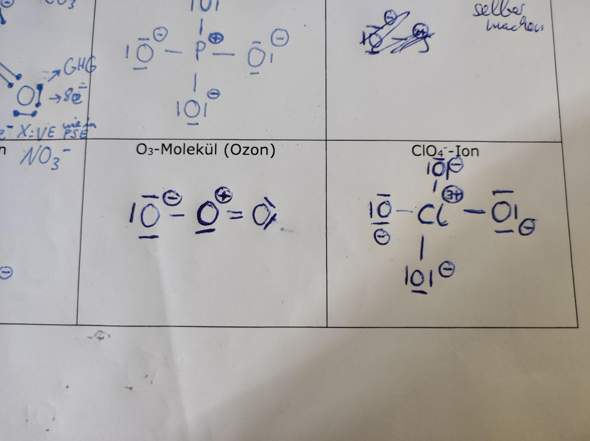
Also wieso ist z.b da bei CIO4 dieses +3 und -
2 Antworten
Das sind Formalladungen.
Ähnlich wie Oxidationszahlen entstehen Formalladungen dadurch, daß man alle Elektronen eines Moleküls je einem Atom zuordnet. Die Zuordnungsregel ist sehr einfach: Ein Atom bekommt seine lone pairs plus die Hälfte der bindenden Elektronenpaare zugeteilt (bei Oxidationszahlen werden die bindenden Elektronenpaare dagegen je nach Elektronegativität dem einen oder dem anderen Partner zugeschlagen, und deshalb kommen andere Zahlen heraus).
Beim Phosphat hat der Phosphor kein lone pair, aber vier Bindungen, er bekommt also vier Elektronen zugeteilt; das ist eines weniger als im neutralen Atom, also ist die Formalladung +1. Die Sauerstoffe haben je drei lone pairs plus eine Bindung, macht 7 Elektronen, das ist eines mehr als im neutralen Atom, also Formalladung −1.
Im O₃ hat das mittlere O drei Bindungen (eine einfache und eine doppelte), macht drei Elektronen, plus ein lone pair, macht also insgesamt 5, das ist eines zu wenig, also bekommt es eine Formalladung von +1. Im Perchlorat hat das Chlor nur 4 Elektronen, also drei zu wenig. Usw usf ad nauseam.
Die Summe aller Formalladungen ist die Ladung des Teilchens, weil die Gesamtladung nur von der Ladung der Kerne und der Gesamtanzahl der Elektronen abhängt, und die Zuteilung der Elektronen an bestimmte Kerne ändert daran nichts.
Ups, da warst du mal wieder etwas schneller...
LG und ein schönes Restwochenende...
Moin,
das sind Formalladungen.
Nimm als Beispiel das Ozonmolekül. In der Lewisschreibweise würde man das folgendermaßen darstellen:
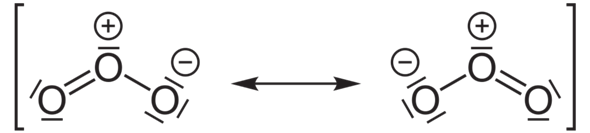
Jetzt betrachten wir einmal das Molekül links. Alle Sauerstoffatome kommen hier auf acht Valenzelektronen und erfüllen damit die Oktettregel bzw. erreichen eine Edelgaskonfiguration. Deshalb ist das Molekül stabil.
Aber das Sauerstoffatom links hat zwei nicht-bindende (freie) Elektronenpaare und zwei bindende Elektronenpaare (eine Doppelbindung). Wenn du hier die Elektronen der Doppelbindung zwischen den Bindungspartnern gerecht aufteilen würdest, dann hätte das linke Sauerstoffatom sechs Valenzelektronen (vier in den beiden freien Elektronenpaaren plus zwei einzelne, nicht gebundene Elektronen). Und das entspricht genau dem Zustand eines ungebundenen Sauerstoffatoms.
Wenn du das aber beim mittleren Sauerstoffatom des linken Moleküls machst, kommst du auf ein freies Elektronenpaar (= zwei Elektronen) plus drei einzelne, unverbundene Elektronen (zwei aus der Doppelbindung und eins aus der Einzelbindung zum rechten Sauerstoffatom. Das macht zusammen (2 + 2 + 1 =) 5 Valenzelektronen. Dieses Sauerstoffatom hat also im Vergleich mit einem unverbundenen Sauerstoffatom formal ein Elektron weniger. Deshalb erhält es eine positive Formalladung (1+), weil es formal ein Elektron abgegeben hat, verstehst du?!
Und wer hat dieses Elektron formal bekommen? - Richtig, das rechte Sauerstoffatom. Denn wenn du bei diesem nachzählst, so hat es drei nicht-bindende, freie Elektronenpaare (= sechs Elektronen) plus ein einzelnes Elektron aus der Einzelbindung. Mit diesen sieben Elektronen hat das rechte Sauerstoffatom formal ein Elektron mehr als ein ungebundenes Sauerstoffatom. Deshalb hat es die Formalladung 1–.
Die beiden Formalladungen gleichen sich hier in ihrer Wirkung aus, so dass das Ozonmolekül insgesamt ungeladen erscheint.
Für das Chlorat-Anion kannst du dir das jetzt einmal selbst erklären...
Wenn du das nicht schaffst, frag im Kommentar noch einmal nach. Dann erkläre ich es dort noch einmal.
Alles klar?
LG von der Waterkant
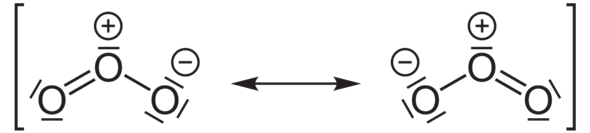
Schau, beim Perchlorat-Anion (ClO4–) hast du ein zentrales Chlor-Atom, von dem vier Einfachbindungen zu den vier Sauerstoff-Atomen ausgehen. Alle fünf Atome erfüllen die Oktettregel bzw. haben eine Edelgaskonfiguration. Deshalb ist das Anion stabil.
Aber wenn du die bindenden Elektronenpaare zwischen dem Chloratom und den vier Sauerstoffatomen gerecht zwischen den Bindungspartnern aufteilst, hat das Chloratom nach der Aufteilung nur noch vier Elektronen. Ein ungebundenes Chloratom müsste aber sieben Elektronen haben (Chlor steht ja in der 7. Hauptgruppe des Periodensystems der Elemente!). Das bedeutet, dass das Chloratom im Perchlorat-Anion formal drei Elektronen abgegeben haben muss. Deshalb bekommt es die Formalladung 3+.
Bei den Sauerstoffatomen ist es viermal das gleiche: Alle haben nach der Aufteilung sieben Elektronen (jeweils drei nicht-bindende Elektronenpaare plus eins aus der Bindung zum Chloratom). Ein ungebundenes Sauerstoffatom hätte aber nur sechs Valenzelektronen (Sauerstoff steht in der 6. HG des PSE). Darum haben alle Sauerstoffatome theoretisch ein Elektron zu viel und somit die Formalladung 1–.
Da du in der Endabrechnung damit einmal 3+ (vom Chloratom) und viermal 1– (von den Sauerstoffatomen) hast, ist das gesamte Teilchen einfach negativ geladen (1 • 3+ + 4 • 1– = 1–)...
Alles klarer jetzt?
Sorry ich steh immer noch ein bisschen aufn Schlauch, trotz deiner detailierten Erkärung