Warum ist SO3 ein Elektrophil?
Sind nicht nur positiv geladene Ionen Elektrophile?
4 Antworten
Elektrophil ist alles, was Elektronen mag. Das kann ein Kation sein (das negative Ladungen sucht) oder auch ein einzelnes Atom in einem Molekül, das unter lokalem Elektronenmangel leidet und sich daher mehr Elektronen wünscht; ein typisches Beispiel sind Moleküle mit Elektronensextett (statt -oktett) wie BF₃.
Im SO₃ hat der Schwefel drei Doppelbindungen zum elektronegativen O und hat daher die sechs Elektronen partiell an den elektronegativen Partner abgegeben. Daher wünscht er sich neue; das sieht man auch daran, daß er sogar zwei Elektronen zum stabilen Sulfit SO₃²¯ aufnehmen kann.
Atome in hohen Oxidationszahlen sind immer tendenziell elektrophil.
Das Schwefelatom ist an drei Sauerstoffe doppelt kovalent gebunden, welche elektronegativer sind. Greift nun ein Nucleophil das Schwefel an, so kann ein Elektronenpaar der Doppelbindung zum Sauerstoff hinklappen, wodurch der Sauerstoff eine negative Ladung bekommt. Diese Ladung ist zudem durch die anderen beiden Sauerstoffe mesomer stabilisiert.
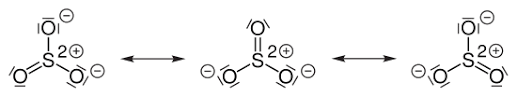
Das Schwefelatom des Schwefeltrioxids, ist aufgrund seiner zweifach positiven Formalladung Elektrophil
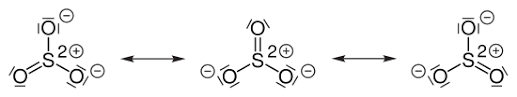
Schwefeltrioxid besteht aus einem zentralen Schwefelatom, das von drei Sauerstoffatomen umgeben ist. Diese Sauerstoffatome sind stark elektronegativ, was bedeutet, dass sie eine starke Anziehungskraft auf Elektronen ausüben.