Hallo, ich habe mir eine PDF mit Übungsaufgaben zum Aufstellen chemischer Strukturformeln heruntergeladen und habe dazu eine Frage.
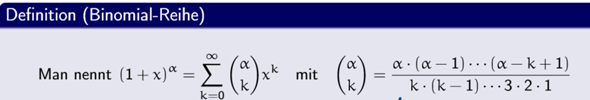
Für das Phosphat-Ion PO43- steht Phosphor P in der V. HG, besitzt also 5 Valenzelektronen und Sauerstoff O in der VI. HG, besitzt also 6 Valenzelektronen.
Ich habe die Summe der Valenzelektronen aller beteiligten Atome des Anions gebildet und bin auf 5(P)+4*6(O))+3 = 32 gekommen. Ich habe für die Strukturformel das P-Atom als Zentralatom bestimmt und die 4 O-Atome im 90 Grad Winkel durch eine Einfachbindung drum herum gruppiert, 8 von den 32 Valenzelektronen sind also schon weg und 24 Valenzelektronen müssen noch verteilt werden. Dann habe ich jeweils für die 4 O-Atome 6 Valenzelektronen ergänzt, womit die restlichen 24 Valenzelektronen vergeben sind. Das P-Atom hat 8 Valenzelektronen, also eine volle äußere Schale und erfüllt die Oktettregel. Die 4 O-Atome erfüllen auch jeweils die Oktettregel und haben 8 Valenzelektronen in der äußeren Schale. Die Edelgaskonfiguration wäre also erfüllt und alle Valenzelektronen so verteilt, dass alle Atome eine voll besetzte äußere Schale haben.
Schliesslich habe ich die Formalladung berechnet und bin für das P-Atom auf 4 Valenzelektronen gekommen, Phosphat P hat eigentlich 5 Valenzelektronen also -1 und somit eine Formalladung von +1. Die 4 O-Atome haben jeweils 7 Valenzelektronen, Sauerstoff O hat eigentlich aber 6 Valenzelektronen also +1 und somit eine Formalladung von -1. Wenn man die Formalladungen addiert, kommt man auf (4*(-1))+1 = -3 und somit passt das doch mit der Gesamtladung des Ions von -3?
Ich habe nun die Lösung gesehen und verstehe nicht, wieso in der Lösung 1 der 4 O-Atome durch eine Doppelbindung mit dem P-Atom verbunden ist, wodurch das O-Atom zwar immernoch 8 Valenzelektronen hat, also die Edelgaskonfiguration erfüllt, aber eine Formalladung von 0 hat.
Und das P-Atom hat aufeinmal 10 Valenzelektronen bzw. 5 Bindungen (3 Einfachbindungen, 1 Doppelbindung), geht sowas? Ich dachte, dass alle Atome, die die Oktettregel erfüllen müssen, nur max. 4 Bindungen haben dürfen? Das P-Atom hat außerdem dadurch eine Formalladung von 0. Wenn man die Formalladungen nun addiert, kommt man auf (3*(-1))+0+0 = -3 und somit passt das eig auch wieder mit der Gesamtladung des Ions von -3.
Meine Frage ist nun, warum die Doppelbindung an dieser Stelle notwendig ist, da die Formalladung in meiner Lösung ja mit der Gesamtladung des Atoms übereinstimmen würde und auch die Edelgaskonfiguration erfüllt gewesen wäre, also was war daran falsch?
Und ist es überhaupt möglich, dass ein Atom mehr als 4 Bindungen eingehen kann?