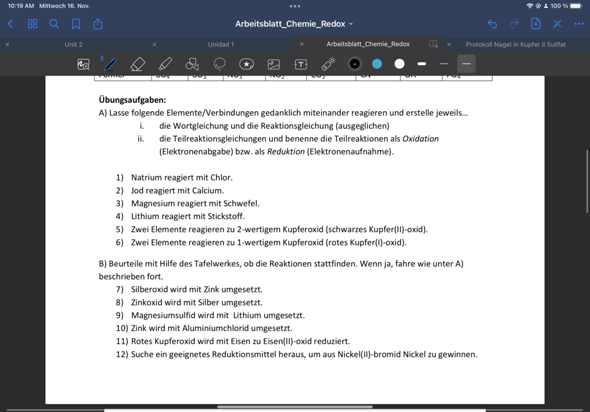
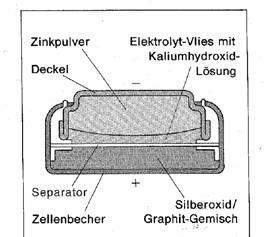
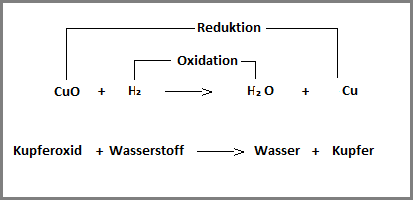
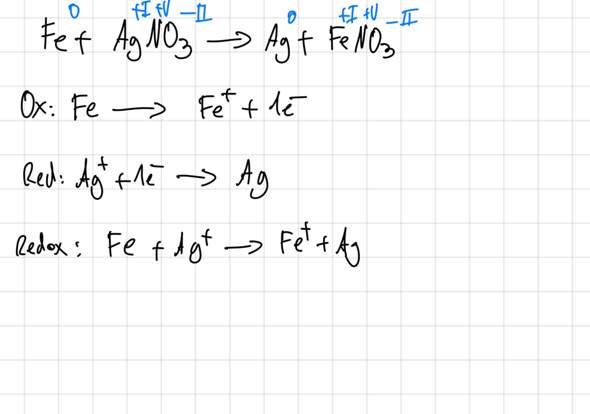Redoxreaktion – die neusten Beiträge
Chemische Funktionsweise von analoger SW-Fotografie?
Ich muss für die Schule (12. Klasse) ein Projekt machen über Redoxreaktionen und habe dafür die Entwicklung von analogen Schwarzweiss-Filmen gewählt. Nur verstehe ich das, was ich dazu gelesen habe, nicht alles ganz.
Der Film besteht aus Silberbromid und als Entwickler wird Hydrochinon verwendet.
Wenn ich das richtig verstanden habe, werden bei der Belichtung des Filmes durch die Photonen Elektronen von den Bromid-Ionen abgespaltet, welche dann mit Zwischengitter-Silber-Ionen reagieren. So entsteht dann elementares Silber und dieses schliesst sich anscheinend zu unsichtbaren Latentbildkeimen/Silberkeimen zusammen (https://www.chemieunterricht.de/dc2/foto/foto-latent.htm).
Dann wird das Bild mit Hydrochinon entwickelt. Dieses wirkt als Reduktionsmittel und reduziert dabei anscheinend Silber-Ionen in der Umgebung dieser Silberkeime zu elementarem Silber, welches dann schwarz wird, wodurch das Negativ entsteht.
Nun verstehe ich aber nicht, weshalb dann nicht alle Silber-Ionen reduziert werden (wodurch ja der ganze Film schwarz würde), sondern nur die in der Nähe der Silberkeime. Anscheinend wirken diese Silberkeime als Katalysator für die Reduktion von Silber-Ionen. Zitat von einer Website: "Dabei kommt es zu einer katalytischen Verstärkung der Reduktion an den Stellen, an denen sich viele Silberkeime befinden, d. h. an den stärker belichteten Stellen." Wie jedoch diese Silberkeime chemisch gesehen als Katalysator wirken, wird auf dieser Seite nicht erklärt und das konnte ich auch sonst nirgendwo finden. Und das ist deshalb auch meine Frage.
Ich wäre wirklich sehr dankbar, wenn mir jemand weiterhelfen könnte, denn wir haben Ferien und unsere Lehrerin kann ich deshalb nicht fragen.