Welche Oxidationsstufe hat nunSauerstoff in Chrom(VI)peroxid?
Also wenn man es für die redoxgleichung angeben muss, hat sauerstoff die oxidationsstufe -1 da peroxid oder -2 ?
1 Antwort
Chromperoxid CrO₅ enthält zwei Peroxogruppen O₂²⁻ und ein gewöhnliches Oxid O²⁻, also CrO(O₂)₂ — vier Sauerstoffatome haben Oxidationszahl −I, eines −II.
CrO₅ ist instabil und läßt sich nur als Anlagerungsverbindung mit Stickstoff-Donoren isolieren. Die Strukturen zeigen immer zwei Peroxo-Gruppen (also so etwas wie einen CrO₂-Dreiring) und ein einzelnes O. Hier zwei Zeichnungen für die Komplexe mit Pyridin und 2,2’-Bipyridyl:
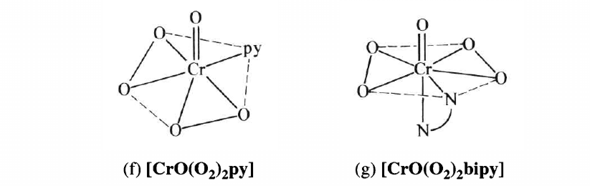
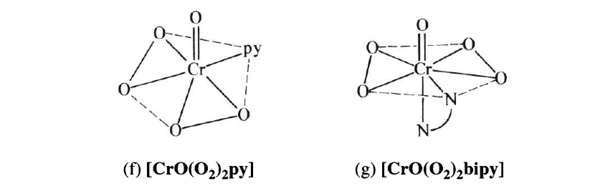
Für das CrO₅-Molekül kannst Du Cr⁺ⱽᴵO⁻ᴵᴵ(O⁻ᴵ₂)₂ schreiben.
Aber in Reaktion ist das nicht so einfach, weil man nicht genau vorhersagen kann, was passiert — immerhin wechseln möglicherweise sowohl die Peroxo-Sauerstoffe als auch das Chrom die Oxidationsstufe, z.B. in saurer Lösung:
2 CrO₅ + 6 H₃O⁺ ⟶ 2 Cr³⁺ + 9 H₂O + 3½ O₂
Es ist relativ unübersichtlich, hier die Halbgleichungen aufstellen zu wollen, weil das Chrom oxidiert, aber die Peroxo-Sauerstoffe teilweise oxidiert und teilweise reduziert werden. Hier arbeitet man besser mit einem ganz anderen Trick: Man überlegt sich den Zerfall von CrO₅ zu Cr₂O₃, was recht einfach ist, denn die überschüssigen 7 O-Atome kann man zu 3½ O₂ verarbeiten
2 CrO₅ ⟶ Cr₂O₃ + 3½ O₂
und dann schreibt man noch genug H₃O⁺ dazu, um das O²⁻ zu H₂O zu protonieren (man braucht natürlich H₃O⁺ pro O²⁻, also 6 insgesamt):
2 CrO₅ + 6 H₃O⁺ ⟶ Cr₂O₃ + 6 H₃O⁺ + 3½ O₂ ⟶ 2 Cr²⁺ + 9 H₂O + 3½ O₂
Vielen Dank für deine Antwort. Aber Ich bin mit unsicher: Wie gebe ich das für die Redoxgleichung an, also welche Oxstufe soll ich dann angeben?