Redoxreaktion zwischen Eisen-Atomen und Silber-lonen?
Soweit ich das verstanden hab ist das dann
Fe-> Fe8+ + 8-
Ag-> Ag11+. + 11-
Fe + Ag -> Fe8+. + Ag11+
stimmt das irgendwie und kann mir das vielleicht jemand noch mal einfach erklären
ich soll das dann Wie in so einer Skizze beschriften
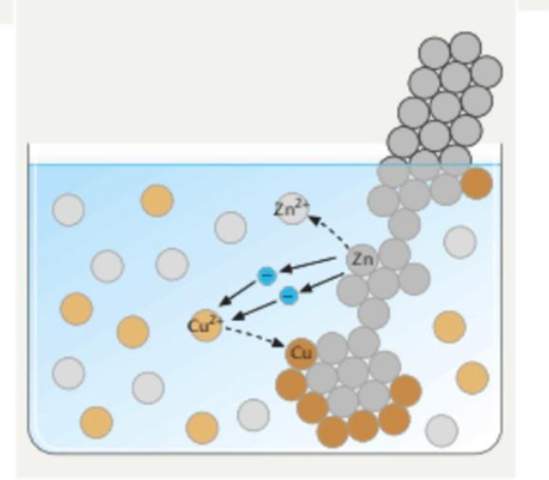
3 Antworten

Das edlere Metall (Silber) wird reduziert, d.h. nimmt Elektronen auf, das unedlere Metall (Eisen) wird oxidiert, gibt Elektronen ab. Wenn das edlere Metall als Ion in Lösung ist und das unedlere Metall in reiner Form vorliegt, geht das unedlere Metall als Ion in Lösung und das edlere Metall setzt sich als Atom in reiner Form ab.
Auf deinem Bild setzt sich das edlere Kupfer in reiner Form ab, die Ionen nehmen Elektronen auf, das unedlere Zink gibt Elektronen ab und geht als Ion in Lösung.

Fe wird zu Fe2+ oxidiert (ein Reduktionsmittel), Ag+ wird zu Ag reduziert (ein Oxidationsmittel), weil das Standardelektrodenpotential an Silber größer, als Potential an Eisen ist.
Die Reaktion lautet:
Fe + 2Ag+-> Fe2+ + 2Ag
O.z=8+ oder 11+ existieren überhaupt nicht.


Moin,
na, dann hast du aber vom Thema Redoxreaktion bisher noch nicht viel verstanden...
Es gibt da so eine Spannungsreihe der Metalle. Darin werden Metalle nach ihrem Redoxvermögen geordnet. Du kannst auch sagen, dass ein Metall, das edler ist, sich weniger gut oxidieren lässt als ein unedleres Metall. Je unedler ein Metall ist, desto weiter links steht es in der Redoxreihe der Metalle. Eine Auswahl an Metallen in dieser Reihung könnte etwa so aussehen:
Li K Ca Na Mg Al Mn Zn Cr Fe Cd Ni Sn Pb [H2] Cu Ag Hg Pt Au
Und wie du siehst, steht Eisen (Fe) hier weiter links als Silber (Ag). Darum ist Silber das edlere der beiden Metalle.
Nun musst du außerdem noch wissen, dass unedlere Metallatome die Ionen von edleren Metallen aus deren Lösungen (Ionenform) „befreien”, indem die Atome der unedleren Metalle selbst zu Ionen werden und dabei Elektronen an die Ionen der edleren Metalle abgeben, so dass diese in ihre atomare Form übergehen können.
Das liegt daran, dass eben die Atome unedlerer Metalle leichter in die Ionenform übergehen, als die Atome edlerer Metalle.
Nun bezeichnet man die Abgabe von Elektronen als Oxidation, während man die Aufnahme von Elektronen Reduktion nennt.
Wie gesagt, sind die Eisenatome (Fe) vom unedleren Metall. Darum geben sie jeweils zwei Elektronen an zwei Silberionen (2 Ag+) ab. Das bedeutet, dass die Eisenatome zu Eisenionen werden (Fe2+). Da die Eisenatome also Elektronen abgeben, werden sie oxidiert.
Die Silberionen (Ag+) nehmen jeweils ein Elektron auf und werden zu atomarem (elementarem) Silber (Ag). Da dies eine Aufnahme von Elektronen ist, handelt es sich also um einen Reduktionsvorgang.
Daraus kannst du also zunächst einmal folgende Teilgleichungen aufstellen:
Oxidationsteilgleichung: Fe → Fe2+ + 2 e–
Reduktionsteilgleichung: Ag+ + e– → Ag
Aber du siehst an der Oxidationsteilgleichung, dass ein Eisenatom zwei Elektronen abgibt und dadurch zu einem zweifach positiv geladenen Eisenkation wird.
Ein einfach positiv geladenes Silberkation nimmt aber nur ein Elektron auf, wenn es zu einem Silberatom wird.
Da aber die Menge an abgegebenen Elektronen beim Oxidationsteilprozess gleich groß wie die Menge an aufgenommenen Elektronen im Reduktionsteilprozess sein muss (Regel der Elektronenneutralität), musst du pro Eisenatom zwei Silberionen heranziehen.
Daraus ergibt sich folgendes Redoxsystem:
Oxidationsteilgleichung: Fe → Fe2+ + 2 e–
Reduktionsteilgleichung: 2 Ag+ + 2 e– → 2 Ag
--------------------------------------------------------------------------------------
Redoxgleichung: Fe + 2 Ag+ → Fe2+ + 2 Ag
Nun erhebt sich noch die Frage, warum zweifach positiv geladene Eisenkationen entstehen und die Silberionen einfach positiv geladen sind?!
Das hat etwas mit dem Feinbau der Elektronenhülle der jeweiligen Atome zu tun. Es würde zu weit führen, wenn ich dir das an dieser Stelle erklären wollte. Nimm also einfach einmal hin, dass Eisen bevorzugt zweifach positiv geladene Ionen bildet (Fe2+) oder manchmal auch dreifach positiv geladene (Fe3+) und Silberionen in der Regel einfach positiv geladen sind (Ag+).
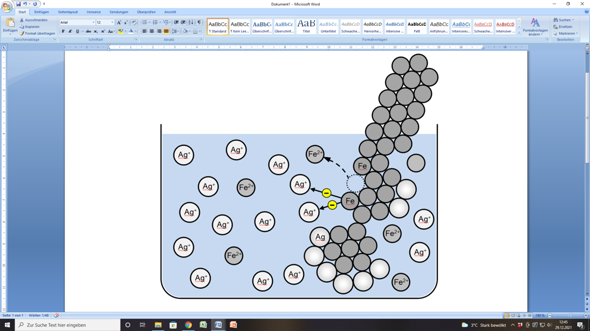
Als Bild könntest du das so malen:
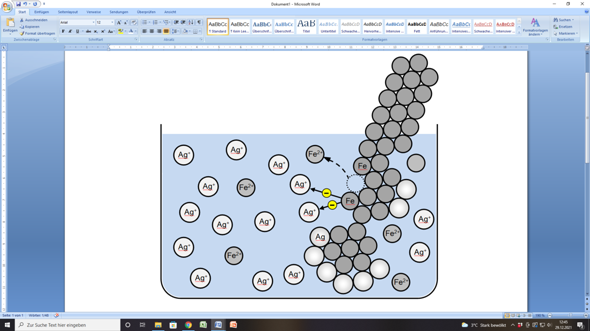
LG von der Waterkant

Danke für die sehr ausführliche Antwort und Erklärung..hat mir echt weitergeholfen 🙏🏼
Die Oxidationsstufe +VIII gibt es schon, zum Beispiel in RuO4, OsO4 oder IrO4.