Hilfe beim Verständnis der Zink-Silberoxid Batterie?
Guten Tag,
ich habe in Chemie gerade das Thema Batterie und muss morgen einen Vortrag über die Zink-Silberoxid Batterie halten. Dazu habe ich noch ein paar Fragen, auf die ich im Internet keine Antwort gefunden habe.
Das sind der Aufbau und die Reaktionsgleichungen:
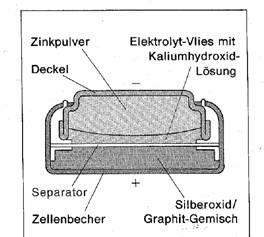
(Minuspol) Oxidation: Zn --> Zn2+ + 2e-
(Pluspol) Reduktion: Ag2O + H2O + 2e- --> 2Ag + 2OH-
Redox: 2Ag+ + Zn --> 2Ag + Zn2+
Gesamt: Ag2O + H2O + Zn --> 2Ag + Zn(OH)2
Das habe ich auch eigentlich alles verstanden. Meine Frage sind jetzt:
- Wofür ist das Kaliumhydroxid da?
- Wo "gehen" die Zink-Ionen hin? Bei einer 'normalen' galvanischen Zelle gehen diese ja dann in die Zinksulfat-Lösung.
- Wo kommt das Wasser in der Reduktion plötzlich her?
- Wo fließt der 'Strom' jetzt lang? Muss der Plus- und Minuspol erst miteinander verbunden werden?
1 Antwort

Hi,
1) das ist der Elektrolyt. Könnte wie bei deiner Standard-Galvanizelle im Buch ein Sulfat oder Chlorid sein, aber dann würden unlösliche Salze ausfallen. (Silbernitrat wird als Nachweis für Chloridionen verwendet)
2) Die bleiben genauso da, wie bei deiner normalen Galvani Zelle. Zinkhydroxid ist ein wasserlösliches "Salz", das im Elektrolyt-Vlies bleibt.
3)aus dem Elektrolyt-Vlies. Die Definition eines Elektrolyten sind bewegliche Ladungsträger; hier ist das ein Gel aus wässriger KOH Lösung im Vlies.
4)Wie bei jeder Batterie (das hier ist eine sogenannte Knopfzelle) fließt der Strom erst dann, wenn über entsprechende Leitungen der Stromkreis geschlossen wird.
m.f.G.
anwesende