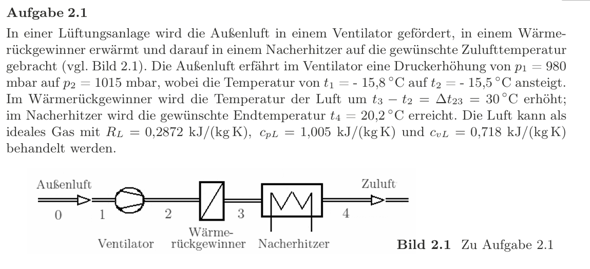
In Vorbereitung auf meine Prüfung rechne ich aktuelle Aufgaben zur Thermodynamik. Ich entschuldige mich vorab, dass hier teilweise immer die gleichen Leute antworten müssen, ich habe aber echt viele Aufgaben zur Verfügung und leider hapert es immer hier und da:
Zur Aufgabe:
Mit 850 kg/h N, wird folgender Kreisprozess durchgeführt: Von einem Ausgangszustand von 1.6 bar und 24 °C wird das Gas dreistufig reversibel adiabat und mit isobarer Zwischenkühlung auf die Ausgangstemperatur verdichtet. Dann isobar auf eine Temperatur von 900°C aufgeheizt. Anschließend wird das Gas reversibel adiabat auf 2.1 bar und 204 °C entspannt und abschließend isobar auf die ‚Ausgangstemperatur abgekühlt.
Man soll nur Stoffwerte aus der Aufgabenstellung, dem Prüfungspaket und den Angaben in den Unteraufgaben verwenden. Keine eigenen Ergebnisse aus anderen Unteraufgaben! (Alle Prozessschritte sind reversibel und Stickstoff kann als ideales Gasangenommen werden.)
geg:
P7 = 45.4 bar
P5 = 14.4 bar
und somit auch m´= 850 kg/h N2
cp für Stickstoff übrigens 1,039 kJ/kg und Gaskonstante 297 J/kgK falls wichtig
a.) In Aufgabe a) ist der Druck p2 in bar gefragt. Ich blicke jedoch nicht ganz durch, wann genau welche Stufe erreicht ist. Gibt es mit der dreistufigen Verdichtung, dann quasi 7 Stufen? und wie errechnet sich der Druck p2?
b.) In b) ist die Temperatur 6 gefragt.
c.) Berechnen Sie das spezifische Volumen, v1 in m’/kg
d.) Berechnen Sie die spezifische Entropie, s8 in kJ/(kgK)
e.) Berechnen Sie den zugeführten Wärmestrom der Zustandsänderung 6->7,
Q´6->7 in kj/h
T6 ist hier zu 407°C
Zur Info: Ich hatte schon überall Ergebnisse eingetragen, habe jedoch keine Rechenwege dazu. Sofern es hilft aber hier meine Lösungen:
a) 4,88 bar
b) 408,44°C
c) 0,55 m3/kg
d) 0,363 kJ/kgK
c) 435392,95 kJ/h
Vorab vielen Dank für jegliche Hilfe. LG