Excel bedingte Formatierung allgemeiner Zellenbezug?
Hallo Leute.
Ist wahrscheinlich eine recht nischige Frage aber hoffentlich kann mir hier trotzdem jemand damit helfen. Folgendes möchte ich tun:
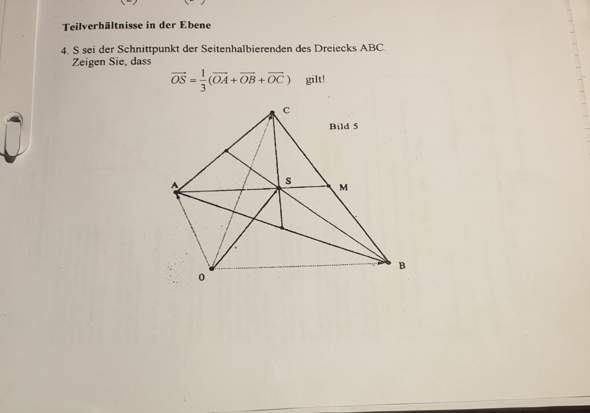
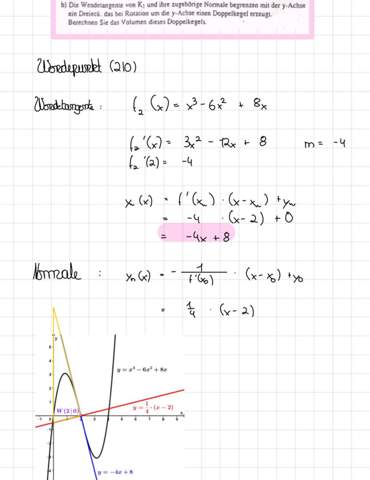
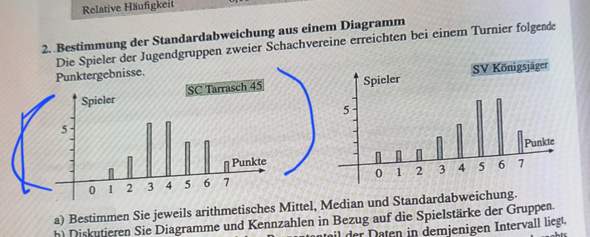
Ich möchte in einem Excel-Dokument jeweils pro Zeile (8 Zellen pro Zeile, Werte zwischen 1 und 5), dann die Zelle gelb markieren, wenn der Wert dieser Zelle mehr als 1 von einer anderen Zelle in der Zeile abweicht. D.h. wenn die Werte so aus sehen: 3,3,2,3,3,3,4,4, dann sollten die 2er und 4er gelb markiert werden, die 3er sollten weiß bleiben (da sie von keinem anderen Wert mehr als 1 abweichen).
Bezogen auf eine Zelle habe ich das mit der Formel ODER(ABS(A1-B1)>1;ABS(A1-C1)>1...) hinbekommen, dass funktioniert aber logischerweise nur in Zelle A1, für B1 müsste es dann wieder neu angepasst werden usw. Einfach die Formatierung kopieren oder verschieben funktioniert auch nicht. Daher wollte ich fragen: Gibt es die möglich eine Formel zu erstellen die anstatt auf die jeweilige konkrete Zelle (A1, B1 usw.) Bezug zu nehmen, einfach immer auf die Zelle Bezug nimmt, in welcher die Formatierung gerade angewendet wird? Ist halbwegs verständlich was ich damit meine?
Es sind mehrere hundert Zellen, d.h. jede Formel für jede Zelle einzeln anzupassen ist keine Option....
Schon mal Danke