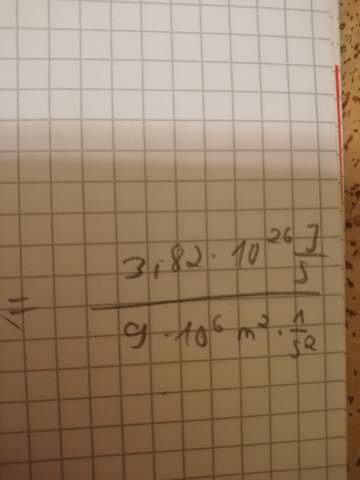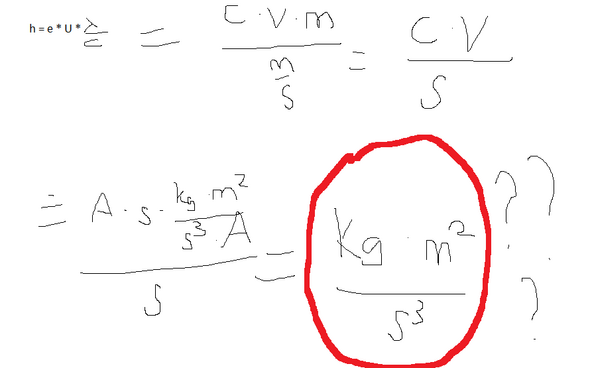Könnte man mit der Energie eines gewöhnlichen Smartphone-Akkus (sagen wir, eines der größeren Modelle, wie bei iPhones):
- eine Defibrillation durchführen?
- einem Auto Starthilfe geben?
Habe da mal was aus dem Bereich der Azubistreiche gehört. Eine Freundin von mir, die eine Ausbildung zur Notfallsanitäterin macht, ist nämlich auch schon mehrmals zum Opfer solcher derber Scherze geworden. Neben dem "13er-Zugang", den es nicht gibt, wurde sie auch schon nach der "Defi-App" gefragt.
Die es aber natürlich so nicht gibt. Wobei es mich trotzdem interessiert, ob man mit einem Smartphone-Akku defibrillieren könnte (ohne Berücksichtigung der Ladezeit und der notwendigen Hochtransformation der Spannung, rein nach Betrachtung der Energie).
Ähnlich ist es mit der "ADAC-Starthilfe-App". Nachdem ich in einschlägigen Online-"Shops" (traumshop.net) Scherzartikel wie ein USB-Starthilfekabel gesehen habe, frage ich mich, ob ein normaler Handyakku ein Auto starten könnte und besagte Starthilfe-App tatsächlich funktionieren würde.
Einige größere Powerbanks können das ja sogar.
Hat also irgendjemand Zahlen dazu und kann das ausrechnen, ob ein Handyakku für eine Defibrillation bzw. Starthilfe ausreicht (und wenn ja, wie oft geht es mit 1 Akkuladung?)?