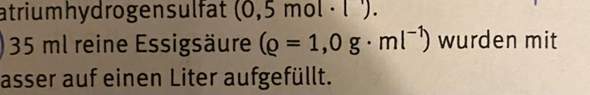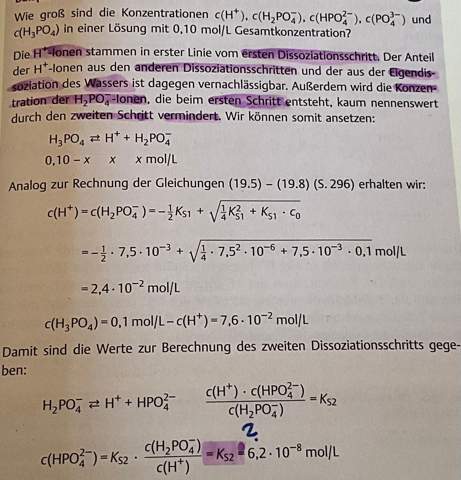Hi,
ich versuche bekannte Säuregrade der Milch, sei es nun Soxhlet-Henkel oder Thörner Grade auf pH-Werte umzurechnen. Vorab: Mir ist durchaus klar, dass beide Maßen nicht exakt vergleichbar sind, aber mit Abweichungen von ± 1,2° SH bzw. ± 0,13 pH, wie hier erwähnt ( https://link.springer.com/article/10.1007/BF01088717 ) kann ich durchaus leben.
Die "Titration: Berechnung" beschrieben hier ( https://medsolut.com/de/blog/titration-berechnen/ ) scheint mir schlüssig zu sein:
1) Mengenverhältnis ist klar 1:1 nachdem die Natronlauge die Milchsäure in der Milch zum Äquivalenzpunkt gebracht hat.
2) Umrechnung der Stoffmenge der Milchsäure n(C3H6O3): Wir wissen den Volumen (die Grade entsprechen die hinzugefügten mL) und die Konzentration der Natronlauge – dabei verwende ich lieber Thörner Grade ( https://de.wikipedia.org/wiki/Grad_Th%C3%B6rner ), da man mit 0,1-molarer Natronlauge leichter Logarithmen berechnet – n=c*V
3) Umrechnung der Konzentration der Milchsäure c(C3H6O3): da wir schon die Stoffmenge berechnet haben, und den Volumen der Milchprobe (immer 0,1 L) wissen, ist das c=n/V
4) Den letzten Schritt ist den pH-Wert anhand der Gleichung der schwachen Säuren zu berechnen: pH=1/2*(pKs – log(c(HA)). pKs steht in Wikipedia: 3,9.
Allerdings komme ich mit diesen Rechenschritten nie zum vernünftigen Ergebnis, denn bei der Kontrolle - normale Milch hat einen Säuregrad von ca. 17 °Th – komme ich nicht auf den ph-Wert 6,7 für normale Milch.
Was mache ich falsch?