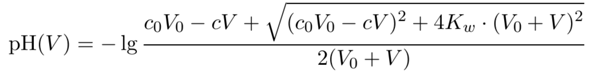pH wert berechnen?
Berechnen Sie den pH-Wert von 100 mL Salzsäure c( = 0,1 mol/L) nach der Zugabe von 9 mL, 9,9 mL, 9,99 mL, 10 mL und 10,01 mL Natronlauge (c = 1mol/L). Ich komme da leider nicht weiter wäre nett wenn mir jemand helfen könnte.
1 Antwort
Dafür gibt es sogar eine fix-und-fertige Formel: Wenn Du V₀=100 ml einer c₀=0.1 mol/l HCl hast und dazu V ml einer c=1 mol/l NaOH dazuschüttest, bekommst Du den pH-Wert
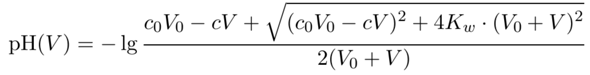
Aber man kann es sich natürlich auch stückweise durchdenken:
- In der HCl sind anfangs n₀=c₀V₀=10 mmol enthalten
- In den V=9 ml NaOH sind n=cV=9 mmol NaOH enthalten
- Nach der Neutralisation bleibt also nur 1 mmol HCl übrig, gelöst in 109 ml Lösung
- Also ist die HCl-Konzentration c=1/109=0.00917 mol/l, und pH=−lg(c)=2.04
Bei den anderen Volumina gehst Du gleich vor; wenn nach der Neutralisation nicht HCl, sondern NaOH übrigbleibt, dann mußt Du natürlich die pH-Formel für starke Basen verwenden, pH=14+lg(c)
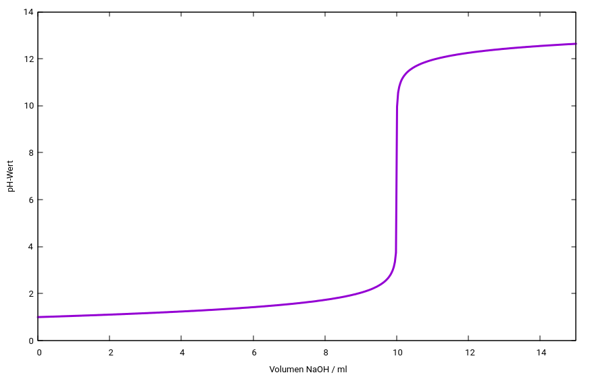
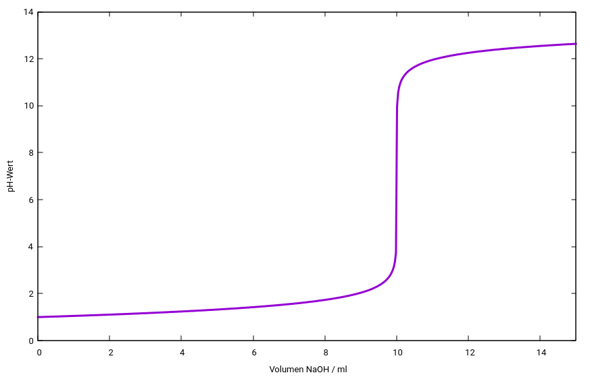
Die gefragten pH-Werte sind 2.04, 3.04, 4.04 und 9.96 — Du siehst, wie absurd stark der pH-Anstieg rund um V=10 ml ist. Das kann man auch graphisch darstellen: