Chemie pH-Berechnung, Essigsäure?
Hi, kann mir jemand bei der Essigsäure-Aufgabe helfen? 35ml Essigsäure ( Dichte= 1,0g/ml) wurde mit Wasser auf einen Liter aufgefüllt… Nan soll den pH-Wert der Lösung berechnen… Ich habe da m= 1,0g/ml • 35ml= 35gr Essigsäure..
dann n= m/M
also n= 35g/ 60,052g/mol = 0,5828 mol nimmt man jetzt hier den -log? also pH= -log(0,5828) und dann kommt da raus 0,234..? kann nicht sein oder?
1 Antwort
Du hast richtig erkannt, daß es sich hier um eine c₀=0.583 mol/l Lösung von Essigsäure in Wasser handelt. Um den pH zu berechnen, mußt Du beachten, daß Essigsäure eine schwache Säure ist; irgendwo in Deiner Angabe sollte auch die Säurekonstante angegeben sein, z.B. pKₐ=4.75 oder Kₐ=1.8⋅10¯⁵ mol/l (=10¯ᵖᴷᵃ).
Den pH-Wert kannst Du einfach mit der Formel pH=−lg(√(Kₐ⋅c₀))=½(pKₐ−lg(c₀))=2.49 berechnen, oder (wenn Du die Formel vergessen hast) durch Umformen des Massenwirkungsgesetzes. Diese Formel gilt nur für schwache Säure, und sie ist die einfachste, die in diesem Fall funktioniert; es gibt natürlich noch einen Haufen weitere, die Du auch verwenden könntest, weil sie in diesem Fall dasselbe Ergebnis liefern.
Eine zugegebenermaßen etwas exotische Alternative wäre z.B.
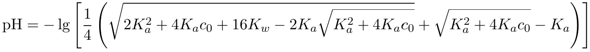
Die sieht zwar einen Haufen komplizierter aus, aber sie ist die einfachste Formel, die den pH-Wert von Essigsäure in jeder Konzentration richtig wiedergibt. Die einfache Formel, die ich oben angegeben habe, funktioniert nur für relativ große Konzentrationen; unterhalb von 10¯³ mol/l weicht sie immer mehr vom richtigen Resultat ab, und bei 10¯⁴ mol/l beträgt der Fehler bereits 0.1 pH-Einheit, bei 10¯⁵ mol/l sogar unakzeptable 0.27 pH-Einheiten. Bei anderen Säuren liegen die Grenzen anderswo.
Hier siehst Du den pH-Wert von Essigsäure je nach Konzentration. Die Konzentration ist logarithmisch aufgetragen (x=2 entspricht c=10¯²=0.01 mol/l), und die drei Kurven zeigen den echten pH-Wert (orange) und die Resultate der billigen Näherungsformeln für starke (violett) und schwache (grün) Säuren.
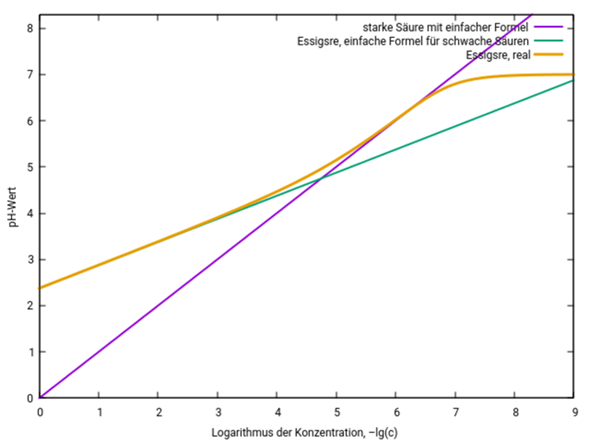
Essigsäure verhält sich bei Konzentrationen bis ein Stück unterhalb von 10¯³ mol/l wie eine schwache Säure, aber bei Konzentrationen um 10¯⁶ mol/l wie eine starke; außerdem wird der pH natürlich durch das Autoprotolysegleichgewicht des Wassers immer unter 7 bleiben. Deshalb funktionieren die Näherungsformeln nur in bestimmten Konzentrationsbereichen. Für die üblichen Konzentrationen (0.1 bis 0.001 mol/l) ist die Formel für schwache Säuren gut anwendbar.
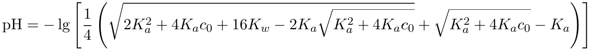
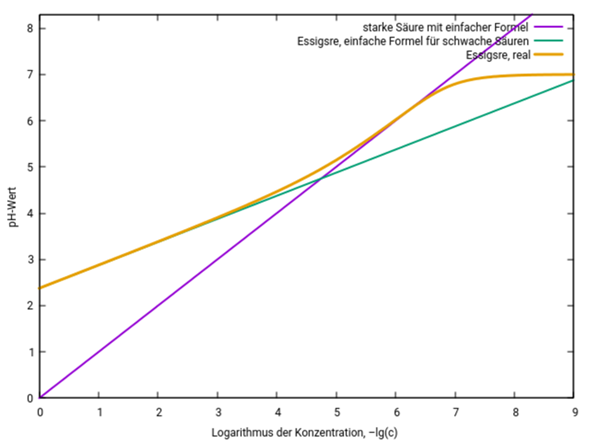
Ich habe noch eine Graphik zur Antwort ergänzt, die den ganzen Konzentrationsbereich abdeckt. Für übliche Konzentrationen ist Essigsäure ganz bestimmt schwach.
hab die formel = 1/2 (pks -log (0,583mpl)= hab da 2,44 pH-Wert raus
okay danke dir :) dachte es wäre eine starke Säure, deswegen direkt -log.