Titrationskurve bei Oxalsäure?
Guten Abend,
Ich zitriere 100 ml Oxalsäure mit einer Konzentration von 0,1 mol pro Liter mit Natronlauge der Konzentration ein Mol pro Liter.
Nun ist die Frage, an welchen Stellen der Titrationskurve sich die Äquivalenzpunkte befinden
Mein Ansatz folgender:
Da beide Stoffmengen gleich sein müssen, komme ich auf den ÄP 0,01 L NaOH. Somit ist der Halbäquivalenzpunkt bei der Hälfte, also 0,005L.
Wie komme ich nun aber auf die pKs Werte?
Brauche ich die Henderson Hasselbalch Gleichung? Wenn ja, woher weiß ich, was ich einsetzen muss?
Vielen Dank im Voraus für Antworten!!
Liebe Grüße und einen schönen Abend!
3 Antworten
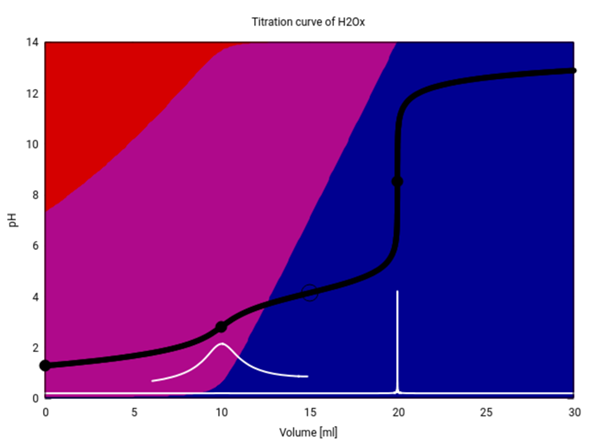
Entschuldige, das sehe ich mit gehöriger Verspätung. So sollte Deine Titrationskurve aussehen (schwarz), zusätzlich ist die erste Ableitung davon weiß eingezeichnet, und die Hintergrundfarben geben an, welche Spezies (Oxalsäure rot, Hydrogenoxalat purpur, Oxalat blau) im Gleichgewicht vorliegen. Zur Berechnung habe ich die pKₐ-Werte von Wikipedia verwendet: pK₁=1.25, pK₂=4.14
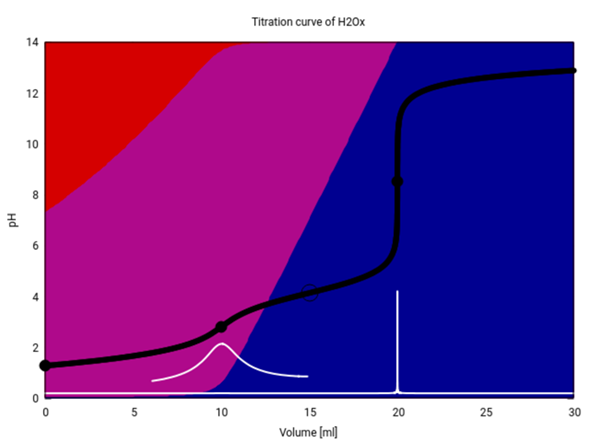
Die beiden Äquivalenzpunkte liegen bei 10 und 20 ml, wie Du richtig ausgerechnet hast. Der erste hat aber nur einen sehr schwachen Sprung, und ich mußte die erste Ableitung um den Faktor 500 vergrößern, damit man das Maximum darin gut erkennen kann.
Bei 15 ml haben wir einen schönen Pufferpunkt. Ein Pufferpunkt entsteht ja, wenn das jeweilige Säure/Base-Paar genau im Verhältnis 1:1 vorliegt (in diesem Fall Hydrogenoxalat und Oxalat). An diesem Punkt gilt pKₐ=pH, daher kannst Du aus der Titrationskurve den pK₂ der Oxalsäure herauslesen; Du nimmst einfach den pH bei V=15 ml.
Es gibt aber keinen Pufferpunkt für die erste Dissoziationsstufe, also das Gleichgewicht zwischen Oxalsäure und Hydrogenoxalat. Das hat einen einfachen Grund: Die Oxalsäure ist in erster Dissoziationsstufe gar nicht so schwach; bereits in der Ausgangslösung (0.1 mol/l) ist mehr als die Hälfte davon dissoziiert (Hinterrundfarben: Rot ist bereits bei V=0 gegenüber Purpur im Hintertreffen). Da die Oxalsäuremenge im Verlauf der Titration nur immer weiter abnehmen kann, erreichst Du niemals das nötige 1:1-Verhältnis.
Nun ist der Dissoziationsgrad einer Säure natürlich konzentrationsabhängig. Wenn wir die Konzentrationen von Proben- und Maßlösung mit jeweils 10 multiplizieren (also perverserweise mit einer 10 mol/l NaOH titrieren), dann gibt es tatsächlich einen Punkt in der Titrationskurve, in dem Oxalsäure und Hydrogenoxalat im Verhältnis 1:1 vorliegen und an dem folglich pH=pK₁ gilt. Allerdings liegt dieser Punkt nicht genau beim Titrationsgrad τ=½ ≙ V=5 ml, sondern kommt merklich frühen, nämlich bei V=4.4 ml. Man kann ihn also nicht so ohne weiteres aus der Kurve herauslesen.
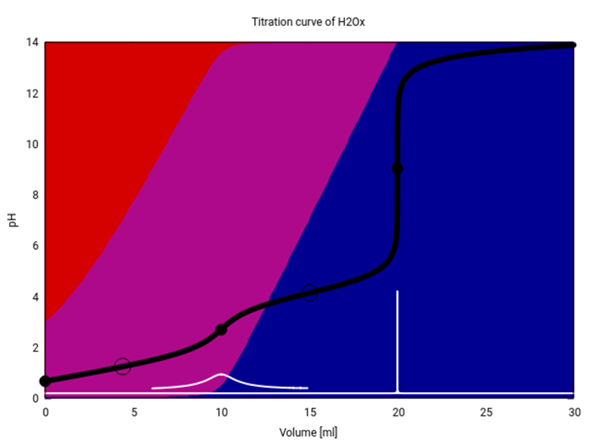
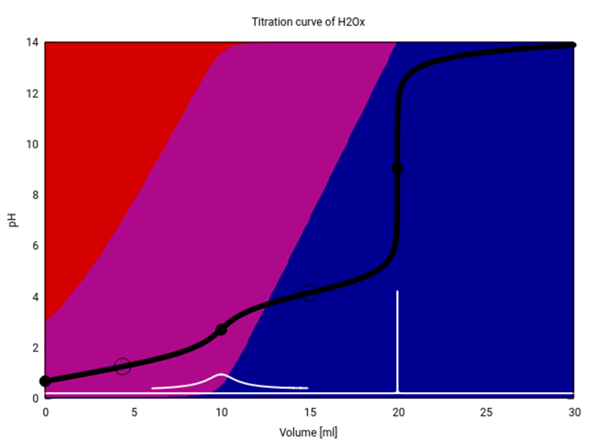
Die pKs-Werte der Säuren entsprechen den pH-Werten an den Halbäquivalenzpunkten. Das sieht man leicht bei der Henderson-Hasselbalch-Gleichung, bei der der Logarithmus bei HA = A⁻ (Halbäquivalenz) Null wird.
pH = pKs - lg(HA/A⁻)
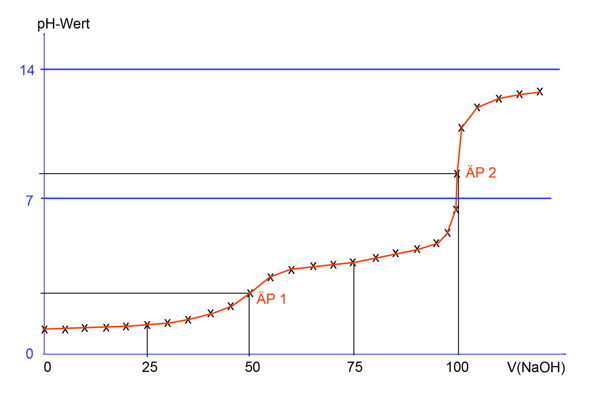
Wenn man eine Titrationskurve erstellt, dann trägt man den pH-Wert gegen die verbrauchte Stoffmenge (oder Volumen) an Base auf. Dann kann man graphisch den Äquivalenzpunkt am Wendepunkt der Kurve ermitteln. Hat man beispielsweise diesen bei 9 mL NaOH, dann ist der pKs gleich dem pH, der bei 4,5 mL NaOH liegt.
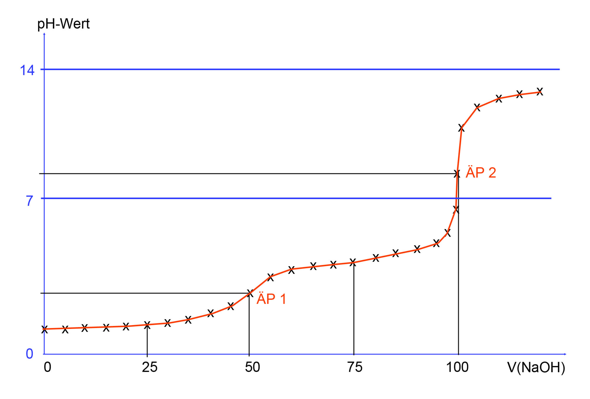
Der pKs1 liegt also irgendwo bei etwas über 1 und der pKs2 etwa bei 4.
Die pKs-Werte einer Säure sind üblicherweise Literaturwerte, die ermittelt man nicht, sondern man entnimmt sie Büchern. Oder Wikipedia ;-)