Haben alle Säuren die einen pKs-Wert besitzen bei der Titration einen Halbäquivalenzpunkt?
Beispiel: Oxalsäure
Ist zwar eine starke Säure aber zweiprotonig. Am ersten Äquivalenzpunkt haben ja alle Oxalsäuremoleküle ein Proton abgegeben (Gleichgewicht vollständig auf Produktseite) , d.h. dass das Verhältnis von Oxalsäure und Hydrogenoxalat zuvor mal 1:1 betrug (Gleichgewicht in der Mitte). Daher müsste doch an der Stelle ein Puffersystem greifen, was auf einen halbäquivalenzpunkt schließen lässt. Nun wiederspricht sich das mit der Tatsache, dass starke Säuren keinen Halbäquivalenzpunkt besitzen.
1 Antwort

Der Äquivalenzpunkt ist dort, wo die Lösung nominell nur aus einer Spezies besteht (zB. Hydrogenoxalat oder Oxalat), der Halbäquivalenzpunkt dort, wo die Lösung reel aus zwei Spezies im Verhältnis 1:1 besteht (z.B. Oxalsäure/Hydrogenoxalat).
Beachte im ersten Satz das nominell. Wie die Lösung wirklich zusammengesetzt ist, hängt von den Gleichgewichten ab (eine nominell reine PO₄³⁻-Lösung enthält je nach Konzentration ≈30% HPO₄³⁻). Darauf kommt es aber für der Definition des ÄP nicht an, weil der ja stöchiometrisch definiert ist. Wenn die Lösung auch reel von einer Spezies dominiert wird, dann sieht man den ÄP als pH-Sprung, sonst nicht.
Beim HÄP ist es dagegen sinnvoll, die Definition umgekehrt zu machen: Dort sollten wirklich zwei Spezies 1:1 vorliegen, damit die Pufferkapazität hoch ist und pH=pKₐ gilt. Deshalb muß der HÄP nicht genau in der Mitte zwischen zwei ÄPs liegen, sondern kann sonstwo sein.
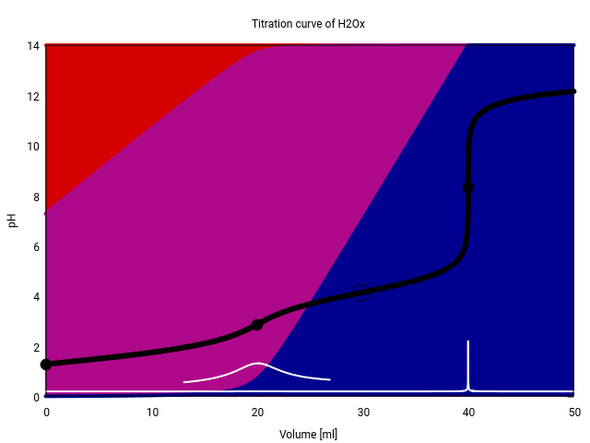
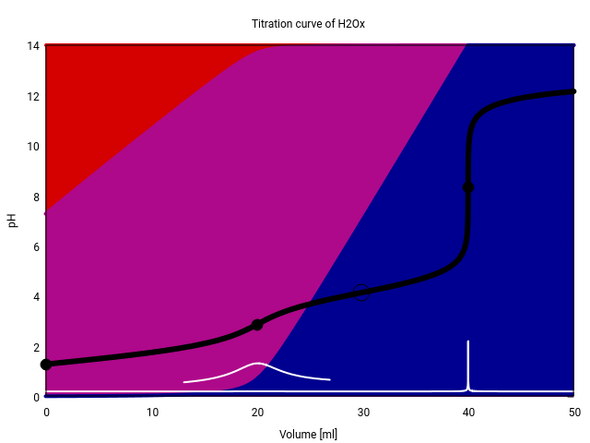
Das ist die Titrationskurve von Oxalsäure. Schwarz der pH, weiß seine erste Ableitung (mit Vergrößerung beim ersten, mageren Sprung) und mit der Verteilung zwischen den drei Spezies (rot: Säure, purpur: Monoanion, blau:Dikation) im Hintergrund. Ein ÄP erscheint als schwarzer Kreis, HÄP als Ring (20 ml 0.1 mol/l Oxalsäure mit 0.1 mol/l NaOH).
Du siehst, daß am ersten ÄP nur ein müder Sprung auftritt, weil nur ca. 92% als Hydrogenoxalat vorliegen, dazu gibt es Oxalat und sogar noch ein bißchen Säure.
Der zweit HÄP liegt ungefähr dort, wo man ihn erwartet. Aber wo ist der erste? Offenbar bei negativem Verbrauch, denn bereits beim Beginn der Titration haben wir mehr als 50% Hydrogenoxalat, dann wird es immer mehr, also kriegen wie den Punkt Oxalsäure : Hydrogenoxalat=1:1 gar nie zu sehen.
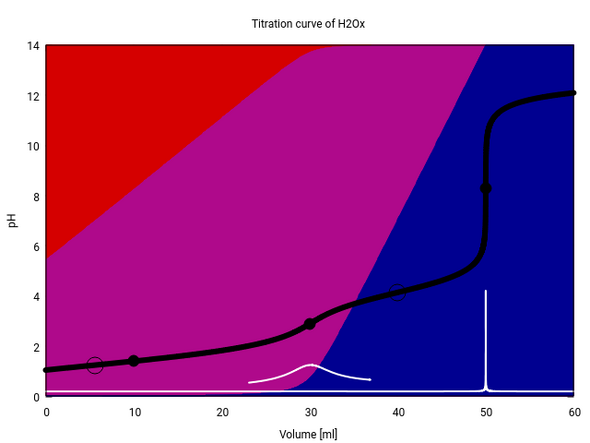
Man kann aber tricksen und die Titrationslösung mit zusätzlich 0.05 mol/l HCl versetzen und dadurch das, weis bei der ersten Titration „negativer Verbrauch“ war ins Positive ziehen:
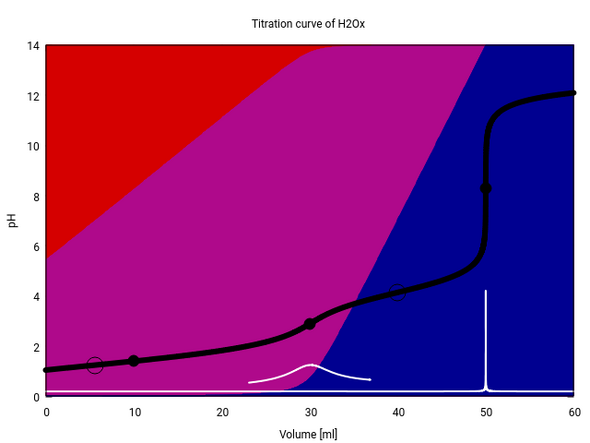
Wir haben jetzt drei ÄP (Oxalsäure bei 10 ml, Hydrogenoxalat bei 30 ml und Oxalat bei 50 ml); der erste ist im pH nicht zu sehen, weil die Suppe da völlig erratisch zusammengesetzt ist. Der HÄP liegt vor dem ersten ÄP, weil die Oxalsäure so stark ist, daß sie nur bei Zugabe von HCl wenigstens zur Hälfte protoniert vorliegt.
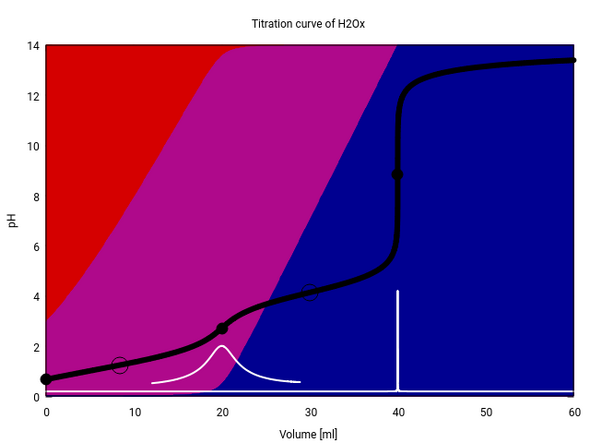
Die Lage der HÄPs ist aber konzentrationsabhängig. Bei höheren Konzentrationen ist der Dissoziationsgrad ja immer geringer. Wenn wir eine 1 mol/l Oxalsäure mit einer 1 mol/l NaOH titrieren (ohne Säurezugabe), dann bekommen wir einen HÄP bei positivem Verbrauch.
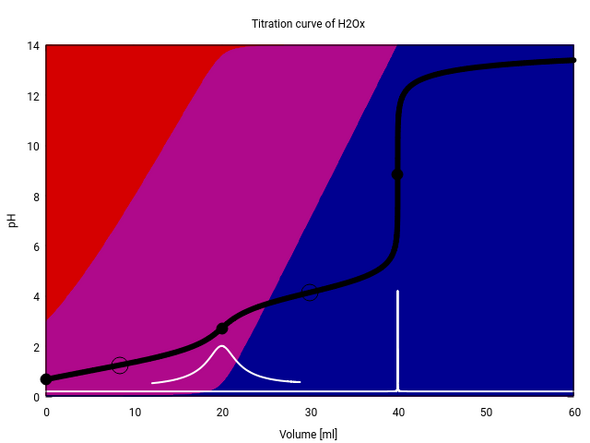
Er liegt zwar nicht bei den naïv erwarteten 10 ml Verbrauch, aber auch nicht allzu weit davon entfernt.