brauche hilfe zu einer chemie-aufgabe: TITRATION!
kann mir jemand bei der aufgabe helfen?
ZEICHNE DIE KURVE,DIE DURCH TITRATION VON 20ML BLAUSÄURE DER KONZENTRATION C=0,05MOL/L MIT KALILAUGE DER KONZENTRATION 0,1MOL/L ENSTEHT. ANLEITUNG: ERMITTLE JEWEILS DEN PH WERT UMD VERBRAUCH AM ÄQUIVALENZPUNKT UND AM HALBÄQUIVALENZPUNKT SOWIE DEN PH WERT ZU BEGINN UND ZUM SCHLUSS DER TITRATION(DOPPELTER ÄP-VERBRAUCH)!!!!
SOWEIT BIN ICH GEKOMMEN:
BLAUSÄURE IST EINE SCHWACHE SÄURE ALSO PH=0,5*(9,4-lg(0,05))=5,3
KALILAUGE IST EINE STARKE BASE ALSO c(OH)=Co(KOH)=0,1 -lg(OH-)=pOH=1 --> pOH+pH=14 also ist der pHwert 13
ist das richtig? und den rest bekomme ich einfach nicht hin:(
3 Antworten
Den pH-Wert am Start hast du schon richtig raus. Außerdem solltest du dir noch überlegen, nach welchem Volumen an KOH der ÄP erreicht wird. Das ist der Fall, wenn soviel Base zugesetzt wurde, wie am Anfang Säure vorlag. Wieviel Säure lag vor?
0,05 mol/l * 20 ml = 1 mmol
Wieviel KOH wird dann bis zum ÄP benötigt?
1 mmol / 0,1 mol/l = 10 ml
Der Halbäquivalenzpunkt wird auf halber Strecke zum ÄP erreicht, also nach Zusatz von 5 ml KOH. Dort ist die vorgelegte Säure zur Hälfte zum Cyanid umgesetzt. HCN und CN- liegen also 50/50 vor. Was folgt damit gemäß Henderson-Hasselbalch-Gleichung für den pH-Wert?
Am ÄP hast du eine Lösung von KCN vorliegen, es ist in erster Näherung
pOH = 0,5*(pKB - lg c0) und dann pH=14-pOH
Wie groß ist c0? Du hast am ÄP 1 mmol Cyanid in insgesamt 30 ml Lösung vorliegen...
Der Endpunkt ist lt. Aufgabenstellung nach Zusatz von 20 ml KOH erreicht. Damit hast du einen 10 ml KOH Überschuss (bezogen auf den ÄP). Diese überschüssigen 10 ml KOH werden auf insgesamt 40 ml Lösung verdünnt. Damit ergibt sich:
c(OH-) = 0,1 mol/l * 10 ml / 40 ml; aus c(OH-) kannst du dann wieder pOH berechnen und daraus wieder pH.
Ich weigere mich Fragen zu bearbeiten, die komplett in Capslock verfasst sind. Ein gewisses Grundmaß an Orthographie und gutem Stil sollte auch bei GF möglich sein.
ANSONSTEN HILFT DIR VIELLEICHT DAS HIER: HTTP://DE.WIKIPEDIA.ORG/WIKI/S%C3%A4URE-BASE-TITRATION
Ich meinte natürlich http://de.wikipedia.org/wiki/S%C3%A4ure-Base-Titration
Wie konnte das nur passieren...
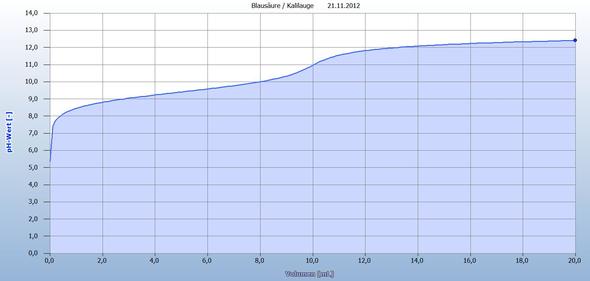
Die Titrationskurve findest Du in der Anlage.