Chemieprotokoll: Welche Beobachtungen bei der Titration mit dem pH-Meter?
Vielen Dank schonmal im Voraus für eure Hilfe!
Wir haben in einem Versuch eine Essigsäure unbekannter Konzentration mit einer NaOH-Maßlösung titriert. Dabei haben wir auch ein pH-Meter eingesetzt.
Wir sollen dafür auch wieder ein Protokoll schreiben und ich bin mir unsicher, was ich in dem Teil "Beobachtung" reinschreiben soll. Normalerweise schreiben wir da immer die Farbwechsel von Indikator rein, den haben wir aber diesmal nicht gebraucht.
Geht es da, auch zu schreiben: Es konnte ein rascher pH-Anstieg beobachtet werden, im Bereich pH 6 bis pH 10. Oder nicht? Soll ich auch dazu schreiben, wie viel Maßlösung in dem Bereich verbraucht wurde oder ist das schon die Auswertung?
1 Antwort
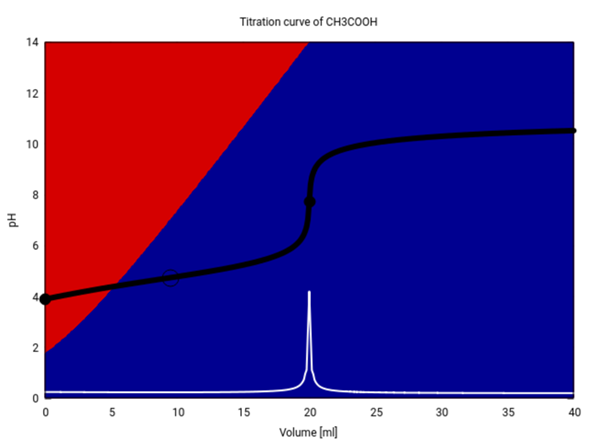
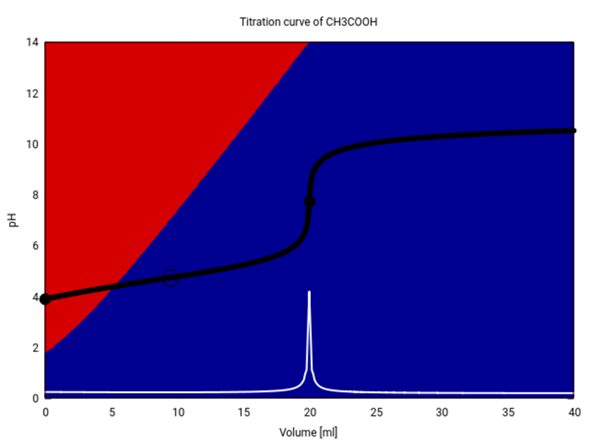
Deine Kurve sollte so ähnlich wie diese hier aussehen (20 ml 0.1 mol/l CH₃COOH mit 0.1 mol/l NaOH titriert):
Dir sollten dabei einige Dinge auffallen:
- Am Anfang hast Du einen merklichen pH-Anstieg, wie er nur bei schwachen Säuren auftritt.
- Danach landest Du in einem langen flachen Bereich, in dem der pH in der Nähe des pKₐ=4.75 herumkrebst. Das liegt daran, daß jetzt ein Teil der Essigsäure vom Acetat deprotoniert wurde, und zusammen mit der noch verbleibenden Essigsäure bildet der einen Puffer. Auf halbem Weg zum Äquivalenzpunkt gilt genau pH=pKₐ, dieser Punkt ist mit einem Kreis markiert.
- In den Hintergrundfarben siehst Du die jeweiligen Anteile an Essigsäure (rot) und Acetat (blau). Wir beginnen mit ≈99% Essigsäure und bauen dann stetig Acetat auf. Die Pufferwirkung tritt ein, sobald ⪆10% Acetat vorliegen, und verschwindet, wenn das Acetat ⪆90% erreicht. Es puffern ja nur Lösungen aus ähnlichen Mengen Essigsäure und Acetat.
- Der pH-Sprung am Äquivalenzpunkt erstreckt sich grob von pH=6 bis pH=11. Jeder Indikator, dessen Umschlagbereich in dieses Intervall fällt, eignet sich zur Titration.
- Danach wird es sehr flach, und der pH nähert sich dem der reinen Maßlösung an, bei 0.1 mol/l NaOH wäre das 13.
- Der pH-Sprung am Äquivalenzpunkt ist sehr scharf und läßt sich gut erkennen. Im winzigen Intervall zwischen 19.95 ml und 20.05 ml springt er satte 2.75 Einheiten. Die weiße Kurve ist die erste Ableitung der Titrationskurve, und man kann hier wirklich die Schärfe des Maximums bewundern.
- Das bedeutet aber auch, daß die Titration sehr genau durchgeführt werden kann, weil man den Äquivalenzpunkt locker auf 0.1 ml genau sehen kann.
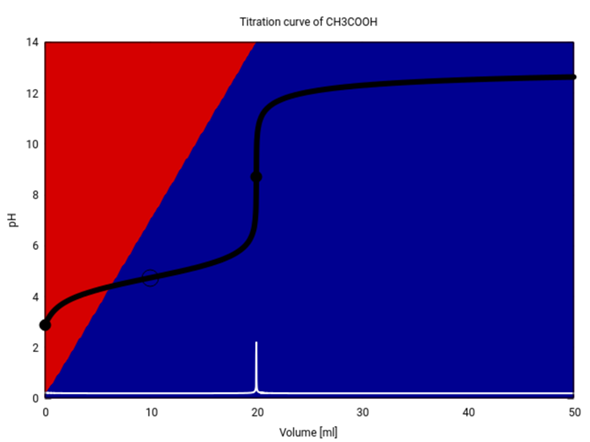
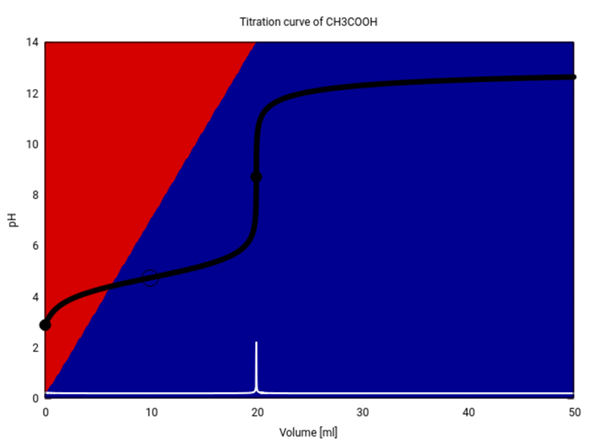
Der letztere Punkt ist natürlich auch konzentrationsabhängig. Wurde man eine 0.001 mol/l Essigsäure mit 0.001 mol/l NaOH titrieren, dann wäre die Kurve am Äquivalenzpunkt nicht so steil: