Verbrauch bei einer Titration berechnen?
Aufg.: eine schwache Säure (c=0,1mol/L) mit einem Ks-Wert von 3,16*10^-6 mol/L wird mit NaOH -Maßlösung (c=0,2mol/L) titriert. Dafür werden 50,0mL Säure vorgelegt.
a) wie viel mL maßlösung werden bis zum halbtitrationspunkt verbraucht?
b) wie viel mL maßlösung werden bis zum Titrationsgrad 0,9 verbraucht?
c) wie viel ml Maßlösung werden bis zum Äquivalenzpunkt verbraucht?
wie berechnet man das?
1 Antwort
Die Berechnung ist einfach genug: Die 50 ml Säurelösung enthalten n=cV=5 mmol Säure, das reagiert mit ebensoviel Natronlauge, also brauchst Du ein Volumen von V=n/c=25 ml bis zum Äquivalenzpunkt (Titrationsgrad τ=1). Für andere Titrationsgerade beträgt das Volumen dann natürlich V=τ⋅n/c; für den Halbäquivalenzpunkt (τ=½) sind es z.B. genau 12.5 ml.
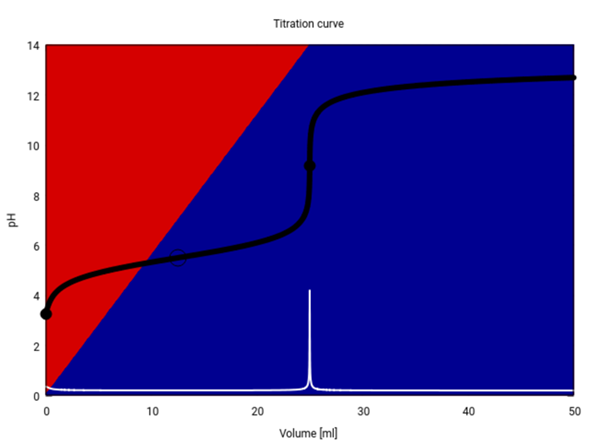
Als Bonus gibt es hier noch die Titrationskurve. Die schwarze Kurve ist der pH in Abhängigkeit vom Verbrauch, die weiße ist die erste Ableitung davon, und die Hintergrundfarben geben an, welcher Anteil als Säure (rot) bzw. Anion (blau) vorliegt.
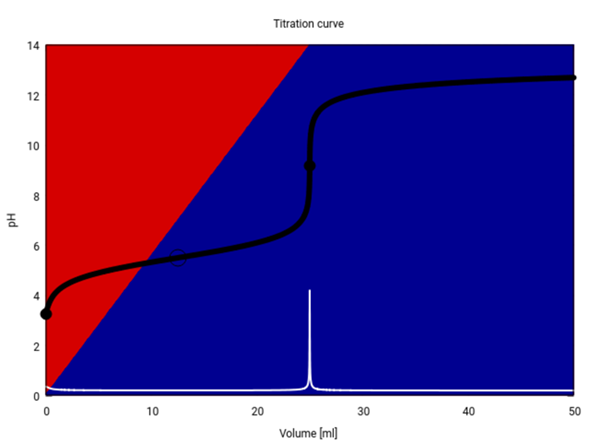
Du siehst, daß der pH-Sprung beim Äquivalenzpunkt von ca. pH=7 bs pH=11 reicht; wenn Du die Titration mit einem Indikator durchführst, dann brauchst Du einen, der genau in diesem Bereich umschlägt, z.B. Phenolhthalein. Da de Säure ziemlich schwach ist, beginnen wir bei einem relativ hohen pH von 3.25, der auch noch rasch ansteigt und am Halbäquivalenzpunkt (12.5 ml, markiert mit einem leeren Kreis) den erwarteten Wert pH=pKₐ=5.5 annimmt.