Man titriert 0,01 Molare Essigsäurelösung mit NaOH. Wie ist der pH Wert am Äquivalenzpunkt?
Welche Konzentration hat die NaOH?
Leider war in der Aufgabenstellung zu NaOH nichts angegeben. Deswegen hat sich die Frage bei mir ergeben.. aber trotzdem danke für die Antworten
2 Antworten
Sehen wir uns das zunächst mal an mit gleicher Konzentration für NaOH und CH₃COOH, also beides 0.01 mol/l:

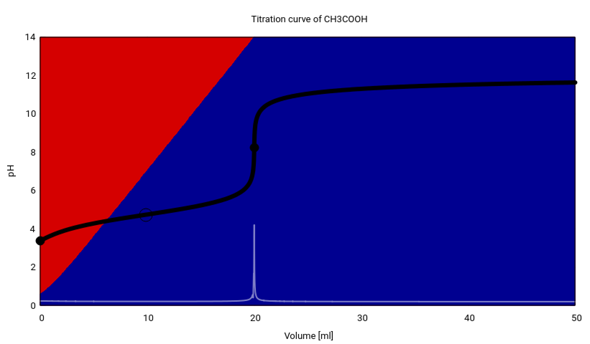
Hier siehst Du die ganze Titrationskurve. Weil ich 20 ml CH₃COOH genommen habe, liegt der Äquivalenzpunkt bei genau 20 ml, und der Äquivalenzpunkt hat pH=8.23. Außerdem siehst Du an den Hintergrundfarben, daß die Essigsäure (rot) im Verlauf der Titration immer mehr verschwindet und dem Acetat (blau) Platz macht.
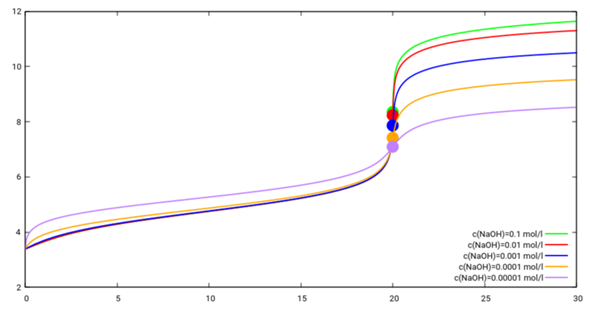
Aber ich weiß nicht, ob ich mit c(NaOH)=0.01 mol/l richtig liege, weil Du meine Nachfrage nicht beantworten willst. Deshalb rechnen wir das mit verschiedenen NaOH-Konzentrationen durch; damit der Verbrauch immer 20 ml Maßlösung beträgt, muß man natürlich immer ein geeignetes Volumen der 0.01 mol/l Essigsäure vorlegen.

- Eine 1 mol/l NaOH würde das Vorlegen von 2 l der 0.01 mol/l CH₃COOH erfordern und hätte den Äquivalenzpunkt bei pH=8.37. Die Kurve ist nicht eingezeichnet, weil sie der von c(NaOH)=0.1 mol/l sehr ähnelt
- c(NaOH)=0.1 mol/l: Die grüne Kurve hat den Äquivalenzpunkt bei pH=8.35; dazu muß man 200 ml der CH₃COOH vorlegen.
- c(NaOH)=0.01 mol/l: Die rote Kurve hat den Äquivalenzpunkt bei pH=8.23; das ist die oben in mehr Detail gezeigte Kurve (es wurden 20 ml CH₃COOH vorgelegt)
- c(NaOH)=0.001 mol/l: Die blaue Kurve hat den Äquivalenzpunkt bei pH=7.86, dazu wurden 2 ml CH₃COOH vorgelegt
- c(NaOH)=0.0001 mol/l: Die orange Kurve hat den Äquivalenzpunkt bei pH=7.41
- c(NaOH)=0.00001 mol/l: Die violette Kurve hat den Äquivalenzpunkt bei pH=7.10
In jedem Fall hat man am Äquivalenzpunkt eine reine Natriumacetat-Lösung vorliegen. Je nach der Konzentration der Maßlösung hat aber auch diese Acetat-Lösung ziemlich unterschiedliche Konzentrationen und daher auch ziemlich unterschiedlichen pH-Wert.
Genauer: Deine CH₃COOH-Lösung habe die Konzentration c₀=0.01 mol/l, und Du legst V₀ ml davon vor und titrierst mit einer NaOH-Lösung der Konzentration c. Dann liegt Dein Äquivalenzpunkt V bei cV=c₀V₀ ⇒ V=c₀V₀/c und enthält n=c₀V₀ Acetat, also handelt es sich um eine Natriumacetatlösung der Konzentration n/(V+V₀)=c₀/(1+c₀/c), und der pH ist

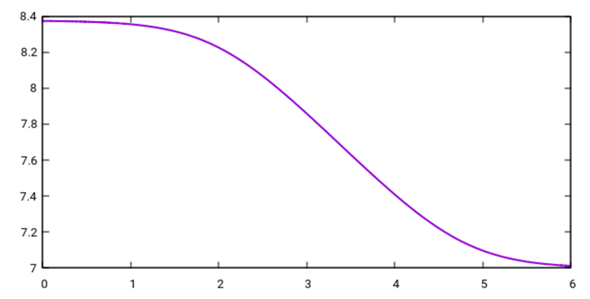
Diese Formel beantwortet Deine Frage mit maximaler Vollständigkeit: Das ist der pH am Äquivalenzpunkt einer Säure mit der Säurekonstante Kₐ (für Essigsäure Kₐ=1.8⋅10¯⁵ mol/l, geht aber für alle Säuren mit Säurekonstanten größer 10¯⁷ mol/l), wenn die c₀-konzentrierte Säure mit c-konzentrierter NaOH titriert wird. Für Deinen Fall c₀=0.01 mol/l sieht die Graphik so aus:

Die Abzissenwerte geben die NaOH-Konzentration logarithmisch an; x=2 bedeutet also c(NaOH)=10¯²=0.01 mol/l. Der pH am Äquivalenzpunkt liegt also zwischen 8.37 und 7.
P.S.: Eigentlich können wir noch einen drauflegen und die Sache auch für variable Essigsäurekonzentrationen berechnen:


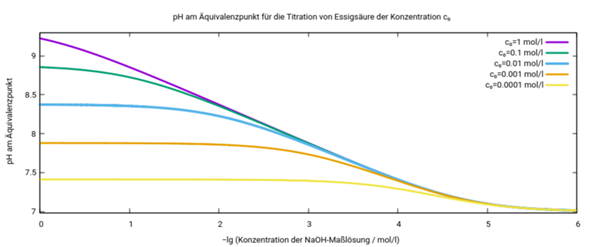
Am ÄP liegt die Essigsäure zu 100 % als Acetat vor. Deshalb ist die Frage, welchen pH-Wert hat eine 0,01 M Acetatlösung. Das Acetat ist eine schwache Base und reagiert mit Wasser gemäß:
Ac⁻ + H2O ⇌ AcH + OH⁻
Der pKb des Acetats ist 9,25 (= 14 - 4,75 für die Essigsäure)
pOH = 1/2*(pKb - log(c)) = 1/2 * (9,25 + 2) = 5,625
pH = 14 - pOH ≈ 8,4
Stimmt, das habe ich schmählich verpennt. Wenn man mit 0,1 M NaOH titriert, ist die Verdünnung allerdings nur geringfügig. Mit c = 0,009 ergibt sich der pH zu 8,35.
Wie kommst Du auf c(Acetat)=0.01? Durch Zugeben der Maßlösung tritt ja Verdünnung ein.