wie berechnet man diesen pH-Wert?
,, Berechnen Sie den pH-Wert für die Titration 3) nach der Zugabe von mindestens 40 ml Ammoniakmaßlösung --> wie geht das?
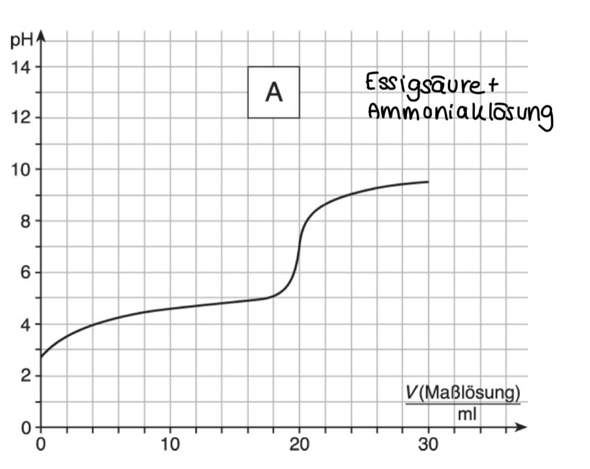
das ist titration 3) essigsäure + ammoniaklösung
,,Es wurden 20 ml ProbeLösung( essigsäure) mit einer Maßlösung (Ammoniaklösung) titriert. die Konzentration betrug 0,1 Mol
.


2 Antworten
Wir titrieren also 20 ml einer 0.1 mol/l Essigsäure mit 0.1 mol/l NH₃ als Maßlösung. Die Neutralisationsreaktion ist
NH₃ + CH₃COOH ⟶ NH₄⁺ + CH₃CO₂⁻
aber wir müssen natürlich beachten, daß Essigsäure als Säure mit dem Wasser H₃O⁺ produziert, und umgekehrt NH₃ als Base OH⁻. Da aber beide schwach sind, passiert das nur und kleinem Ausmaß für die Reinsubstanzen, und jedes der beiden Säure/Base-Paare (also Essigsre./Acetat pKₐ=4.75 und Ammonium/Ammoniak, pKₐ=9.25) kann einen Puffer bilden.
Die folgende Graphik zeigt alle Details dieser unnötig komplizierten Titration. Schwarz siehst Du die Titrationskurve (pH gegen Verbrauch), weiß die erste Ableitung davon, und der strichlierte Teil zeigt den Kurvenverlauf, wenn Du statt NH₃ so wie jeder vernünftige Mensch NaOH als Maßlösung verwendet hättest.
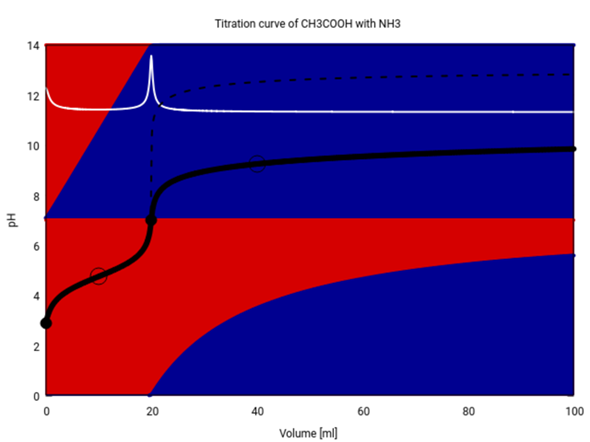
Die Hintergrundfarben zeigen die Zusammensetzung der Lösung (rot für die Säure und blau für die konjugierte Base).
- Oben siehst Du das Essigsäure/Acetat-System. Du beginnst bei V=0 mit weitgehend nur Essigsäure in der Lösung (weil sie schwach ist und nur wenig dissoziiert). Dann wird mehr und mehr Essigsäure vom NH₃ wegneutralisiert; bei 10 ml ist die Hälfte zu Acetat deprotoniert (d.h., Du hast einen symmetrischen Puffer, und es gilt pH=pKₐ=4.75). Ab 20 ml gibt es so gut wie keine Essigsäure mehr im Kolben, weil alles zu Acetat umgesetzt ist. Von da an kann sich nichts mehr ändern, egal wieviel NH₃ Du noch zuschüttest.
- In der unteren Hälfte ist die Situation anders; hier steht rot für NH₄⁺ und blau für NH₃. Solange noch Essigsäure da ist, wird alles zugetropfte NH₃ sofort zu NH₄⁺ protoniert; aber nach V=20 ml, wenn keine Essigsäure mehr da ist, bleibt das neu zugefügte NH₃ erhalten. Sobald sich genug NH₃ angesammelt hat (V≈22 ml) bildet es mit dem bereits vorhandenen NH₄⁺ einen Puffer. Deshalb ändert sich der pH nicht mehr stark Bei V=40 ml ist der Puffer symmetrisch, es liegt also gleich viel NH₄⁺ und NH₃ in der Lösung vor, und es gilt pH=pKₐ=9.25; von da an steigt er nur langsam: bei 50 ml beträgt er 9.43, bei 70 ml 9.66 und bei 100 ml 9.85.
Die NH₃-Maßlösung hat einen pH=11.37, aber der Kolbeninhalt kommt nicht annähernd in diesen Bereich, sondern hängt unter 10 fest. Das legt am Ammoniak/Ammonium-Puffer und kann in dieser Form bei starken Basen wie NaOH als Maßlösung nicht passieren, weil die ja keinen Puffer bilden. Das ist auch der Grund, weshalb kein Mensch NH₃ als Maßlösung verwendet: Das schränkt ja nur den pH-Bereich ein, macht also den Sprung am Äquivalenzpunkt weniger hoch und damit weniger gut sichtbar (in diesem Beispiel ist er immer noch sichtbar genug).
Der Äquivalenzpunkt liegt genau bei 7.0, aber das ist ein Zufall, der darin begründet liegt, daß die Basenkonstante von NH₃ und die Säurekonstante von CH₃COOH zufälligerweise denselben Wert haben, nämlich pKₓ=4.75. Daher reagiert reines Ammoniumacetat (das liegt ja am Äquivalenzpunkt vor) neutral.
Naja, man zwar auch NH₄⁺ + OH⁻ schreiben, aber in einer wäßrigen Ammoniaklösung liegt ja die überwältigende Mehrheit des Stckstoffs (98.7% bei 0.1 mol/l) als NH₃ vor, und nur 1.3% der NH₃-Moleküle reagieren zu NH₄⁺ + OH⁻
Kann es sein, dass du die Frage nicht wortgleich zur Aufgabe gestellt hast? Mir stellen sich hier nämlich einige Fragen:
1: Die Konzentration von was betrug wann 0,1 mol/L?
2: Sollst du wirklich den pH-Wert der Lösung nach Zugabe der Ammoniaklösung berechnen, wenn ja, was war der Ausgangs-pH-Wert?
3: Bis wohin wurde titriert, bis zum Äquivalenzpunkt, bis sich der pH-Wert nicht mehr geändert hat, oder bis wohin?
4: Was soll mindestens 40mL bedeuten?
Nach Zugabe von 20mL 0,1molaren Ammoniaks ist alle Essigsäure verbraucht, das heißt alle weitere Ammoniakzugabe führt nur mehr OH^- zu.
R: NH3(aq) + H2O(l) <-- --> NH4^+(aq) + OH^-(aq)
Das heißt in der Lösung haben wir dann n(NH3) = c0(NH3)*V0(NH3) - c0(HAc)*V0(HAc) mol NH3: 0,1mol/L*0,04L - 0,1mol/L*0,02L = 4*10^-3mol - 2*10^-3mol = 2*10^-3mol.
Das Gesamt-Volumen der Lösung beträgt das Ausgangsvolumen + das zugegebene Volumen V1 = V0 + ΔV = 0,02L + 0,04L = 0,06L
Die Konzentration an Ammoniak in der Lösung ist also:
c(NH3) = n(NH3)/V1 = 2*10^-3 mol/0,06L = 0,0333mol/L.
Jetzt nutzen wir die Formel für die pOH-Wert-Berechnung schwacher Basen:
pOH= ½( pKb - lg(c(NH3)*L/mol) )
pKb = 14 - pKs
der pKs von Ammoniak in Wasser ist: pKs = 9,24
pKb = 14 - 9,24 = 4,76
pOH = 0,5(4,76-lg(0,333)) = 3,12
pH = 14 - 3,12 = 10,88
Ich hätte noch bei 2 kleinen Aufgaben Probleme … kannst du helfen?
Theoretisch ja, praktisch muss ich in 11 Minuten einkaufen gehen.
https://www.gutefrage.net/frage/versteht-wer-englisch-11klasse hab es hier ergänzt
Achja, kurze Ergänzung: Wie du sehen kannst steigt der pH-Wert mit weiterer Basenzugabe langsam an, er nähert sich also dem pH-Wert der der Ausgangskonzentration der Base an. Bei unendlicher Ammoniaklösungszugabe wäre das hier pH= 11,11
Ok danke .. ich hoffe du kannst mir bei 2d und 3 helfen
Jetzt nutzen wir die Formel für die pOH-Wert-Berechnung schwacher Basen:
Lies meine Antwort und schau Dir die Graphik an, dann siehst Du, warum diese Antwort falsch ist.Wenn es Dich tröstet: Ich bin vor ein paar Monaten bei einer ähnlichen Frage in dieselbe Falle gestolpert.
Ich hoffe du kannst mir trotzdem bei aufgabe 2 d und 3 helfen?
Ja, dieses Ergebnis stimmt nicht, weil der pH bei 40 ml Verbrauch gleich dem pKₐ von NH₄⁺ ist, also 9.25 (oder 9.24, je nachdem in welcher Tabelle Du nachsiehst). Das Resultat 10.88 wäre korrekt, wenn Du die 40 ml NH₃-Lösung mit 20 ml Wasser vermischt hättest, aber Du hattest ja 20 ml Essigsäure.
weil der pH bei 40 ml Verbrauch gleich dem pKₐ von NH₄⁺ ist, also 9.25
Warum liest Du nicht, was ich schreibe?
Oh aber ich weiß nicht wie man auf das Ergebnis kommt … man muss ja rechnen
Es ist ein Puffer, also nimmst Du die Henderson–Hasselbalch-Gleichung. Die Lautet ja pH = pKₐ − lg (Säure/Base), da in unserem Fall Säure (NH₄⁺) und Base (NH₃) dieselbe Konzentration haben, kommt pH=pKₐ heraus.
Die Säurekonstante des Ammoniums (pKₐ=9.25) oder alternativ die Basenkonstante des Ammoniaks (pKb=9.25 = 14 − 4.25) ist vermutlich irgendwo in der Aufgabe versteckt;; ohne den Zahlenwert kann man es nicht rechnen.
Und woher weiß man, daß das ein Puffer ist: Weil NH₃ und NH₄⁺ darin in ähnlichen Mengen enthalten ist; jedes Paar aus konjugierter Säure und Base bildet einen Puffer (bei extremen pKₐ-Werten, also knapp an 0 oder 14, verhalten sich die aber komisch).
Und woher weiß man, daß die Konzentrationen gleich sind? Naja, die ersten 20 ml NH₃ wurden von der Essigsäure zu NH₄⁺ verfrühstückt, die zweiten 20 ml nicht und bleiben daher als NH₃ übrig. Also hat man von beidem gleich viel drin.
Oh, danke für die Korrektur, da hab ich einfach mal eben das Puffersystem vergessen ... und genau deswegen sollte man immer soweit titrieren, bis sich der pH-Wert nicht mehr ändert, dann passieren solche Fehler auch nicht. ^^
Es ist ein bißchen teuflisch, weil man bei regulären Titrationen mit starken Basen ja kein derartiges Problem hat und qualitativ das Richtige rausbekommt (nach dem ÄP hat man einen pH, der niedriger ist als es mit NaOH der Fall wäre).
Letztlich wird der pH des Kolbeninhaltes sich natürlich dem der NH₃-Maßlösung annähern, aber leider ∞ langsam — in meiner Graphik habe ich den Nullpunkt der weißen Kurve (1. Ableitung der Titrationskurve) so gewählt, daß sich die Titrationskurve ihr asymptotisch annähert. Selbst nach 100 ml Verbrauch ist man also weit vom End-pH entfernt.
Letztlich zeigt das vor allem, wie pervers und nutzlos NH₃ als Maßlösung ist.
Stimmt, ich hab auch noch nie mit einer schwachen Base als Maßlösung titriert, warum man das machen sollte ist mir aber auch schleierhaft. ^^
Jetzt bin ich verwirrt …wenn man die Reaktionsgleichung macht …
benutzt man für Ammoniaklösung NH3 oder NH4OH