Pks-Wert berechnen?
Wie berechne ich anhand einer Titrationskurve den pks-Wert einer einprotonigen und einer mehrprotonigen Säure, ohne ihn am Halbäquivalenzpunkt abzulesen? Meine Vermutung wäre jetzt, mit dem Ausgangs-pH-Wert zu arbeiten. Klappt das? Und wenn ja, wie berechne ich den pks-Wert dann bei mehrprotonigen Säuren?
Danke
1 Antwort
Wenn die Säure ausreichend schwach und nicht zu stark verdünnt ist, dann ist das Ablesen des pH genau zwischen den Äquivalenzpunkten die beste Möglichkeit, den pKₐ aus der Titrationskurve zu bestimmen. Naja, eigentlich die zweitbeste — am besten ist es natürlich, wenn man die experimentelle Titrationskurve mit einer theoretisch berechneten fittet.
Aus dem Anfangs-pH den pKₐ zu bestimmen, ist möglich, aber weniger gut, weil der Faktor ½ die Genauigkeit begrenzt.
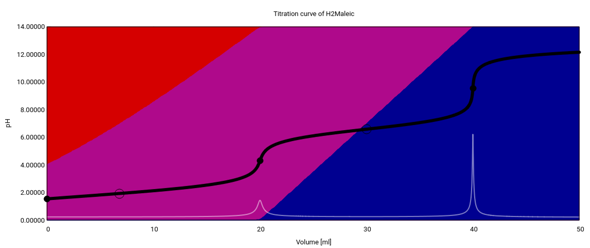
Mehrbasige Säure haben mehrere pKₐ-Werte, und wenn die Zahlenverhältnisse es zulassen, dann kann man sie aus den Pufferbereichen der Titrationskurve gemütlich ablesen; das geht umso besser, je weiter sie auseinander liegen, und je weiter sie von 0 und 14 entfernt sind. Ein Beispiel ist die Maleinsäure mit den pKₐ-Werten 1.93 und 6.58. Ich zeige Dir hier die berechnete Titrationskurve für 20 ml 0.1 mol/l Maleinsäure titriert mit 0.1 mol/l NaOH; die Hintergrundfarben geben die Verteilung der drei Spezies H₂Mal, HMal⁻ und Mal²⁻ (rot, violett, blau) an:

Die pH-Werte bei 10 und 30 ml sind 2.13 und 6.58; der pKₐ₁ liegt recht knapp bei 0 und kommt daher nur ungenau heraus.