Wieso ist [HPO42-] hier Ks2?
Hallo!
Ich verstehe den folgenden Schritt nicht (mit Fragezeichen gekennzeichnet): Warum ist hier [HPO42-] gleich dem Ks2 Wert?
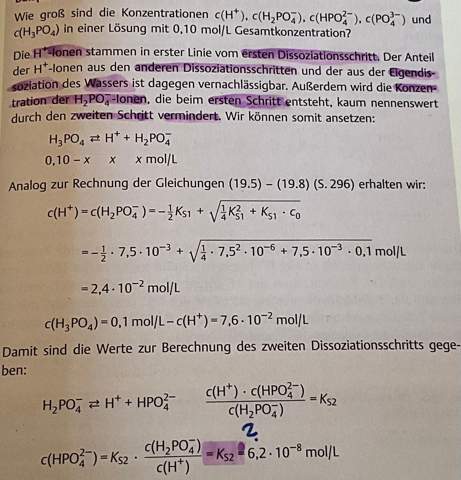
Danke im Voraus!
1 Antwort
H₃PO₄ + H₂O ⟶ H₂PO₄¯ + H₃O⁺
Dieser Schritt bestimmt die Konzentrationen an H₂PO₄¯ und H₃O⁺, und die beiden werden 1:1 gebildet. Da es keine anderen nennenswerten Quellen oder Senken für diese beiden Ionen gibt, liegen diese in der Lösung auch im Verhältnis 1:1 vor. Das steht auch auf Deinem Zettel so, nach „Wir können somit ansetzen“.
Im Gleichgewichtsausdruck für die zweite Säurekonstante steht H₃O⁺ im Zähler und H₂PO₄¯ im Nenner. Also kann man die beiden wegkürzen, und es bleibt Kₐ₂=c(HPO₄²¯) übrig.
Beachte, daß c(H₃O⁺)=c(H₂PO₄¯) nur in reinen Lösungen von H₃PO₄ gilt; wenn Du noch Phosphat, Natronlauge oder Salzsäure dazuschüttest, gilt es nicht mehr. Selbst in reinen H₃PO₄-Lösungen gilt es nur näherungsweise, weil die zweite Protolysestufe und das Wassergleichgewicht noch weitere H₃O⁺ liefern; das ist aber vollkommen vernachlässigenswert, solange die Konzentration der H₃PO₄ nicht absurd klein wird und in den Bereich von 10¯⁷ mol/l kommt.