Zusammenhang zwischen pH-Wert und Lipo- bzw. Hydrophilität?
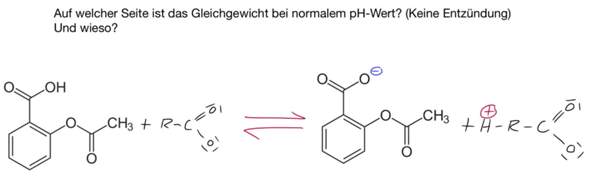
Die Antwort auf die Gleichgewichtsfrage habe ich schon: rechts, da die Säure (Acetylsalicylsäure ganz links) bei normalem pH Wert (7,4), der im gesunden Gewebe ohne Entzündung liegt, gerne sein H abgibt. Nun frage ich mich allerdings, wieso das so ist. Ich verstehe noch nicht ganz den Zusammenhang zwischen Hydro- bzw. Lipophilität, Polarität und dem pH-Wert.
1 Antwort
Ich verstehe Deine Reaktionsgleichung nicht. Das stehen gedruckt die Formeln für Acetylsalicylsäure (Ar–COOH) und das Anion (Ar–CO₂¯), aber dann ist noch irgendetwas handschriftlich dazugekritzelt, was für mich keinen Sinn ergibt. Also ignoriere ich es.
Acetylsalicylsäure ist, große Überraschung, eine Säure, gibt also gerne das H-Atom der Carboxylgruppe an irgendetwas in der Umgebung ab. Meistens ist dieses Irgendetwas Wasser, und dann entsteht H₃O⁺, daher ist ASS unter diesen Bedingungen hydrophil. Unterhalb von pH=3.5 ist ASS zwar immer noch ein polares Molekül, aber zumindest nicht geladen und deshalb deutlich lipophiler.
Ar–COOH + H₂O ⟶ ArCO₂¯ + H₃O⁺
Dabei handelt es sich um ein Gleichgewicht, und die Gleichgewichtslage beschreibt man mit dem pKₐ-Wert, der in diesem Fall pKₐ=3.5 beträgt. Bei einem pH weit unterhalb von 3.5 liegt das Gleichgewicht links, bei einem von weit über 3.5 liegt er rechts.
Im biologischen Medium herrscht typischerweise ein pH ungefähr um 7, also ±neutral (im Blut z.B. ≈7.4). Das ist viel größer als 3.5, also wird die ASS ganz überwiegend als Anion vorliegen. Ionen sind aber sehr polar, also ist das Molekül unter diesen Bedingungen stark hydrophil. Unterhalb von pH=3.5 liegt ASS in der Neutralform vor, dann ist es immer noch ein polares Molekül, aber zumindest nicht mehr geladen; es wird also tendenziell lipophiler sein.
Ja, bei pKₐ=pH liegen genau 50% der ASS als Säure und 50% als Anion vor (1:1). Jede pH-Einheit bringt einen Faktor 10 ins Spiel; bei pH=pKₐ+2 liegt das Verhältnis dann bereits bei 1:100.
Ein Ion ist immer viel hydrophiler und viel weniger lipophil als das zugehörige Neutralteilchen.
Wie gesagt, Dein Gekritzel verstehe ich nicht. Auf der Linken Seite sieht es so aus, also ob die ASS nicht mit Wasser, sondern irgendeinem Carboxylat als H⁺-Akzeptor reagiert (aber es ist keine Ladung eingezeichnet), aber auf der rechten Seite kenne ich mich nicht aus (was soll H⁺–C–CO₂ sein?).
Ich hab das um ehrlich zu sein nur schnell abgeschrieben, bevor die Stunde zuende war. Ich hake da nochmal nach, aber die Erklärung jetzt hat mir schon weitergeholfen, Danke!
„dann entsteht H3O+, daher ist ASS unter diesen Bedingungen hydrophil“
Also besteht Hydrophilität, wenn ein Proton abgegeben werden kann? Oder geht es um die Reaktion mit Wasser? Dann.versteh ichs nicht, da in dem Beispiel oben ja gar kein Wasser zugegen ist, sondern ein anderer Stoff (RCOO, mehr zum Namen kann ich leider nicht sagen, unser Prof hat das nicht weiter ausgeführt).
“Das ist viel größer als 3.5, also wird die ASS ganz überwiegend als Anion vorliegen“.
Also schaue ich mir vergleichend pKa und pH-Wert an und entscheide so über das Gleichgewicht?