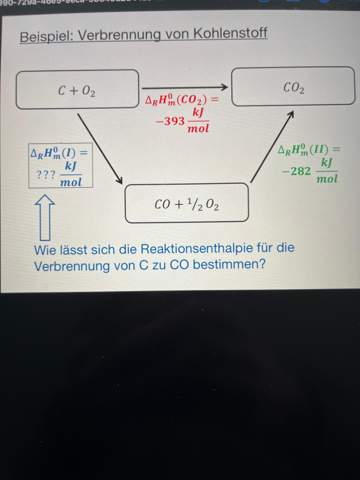
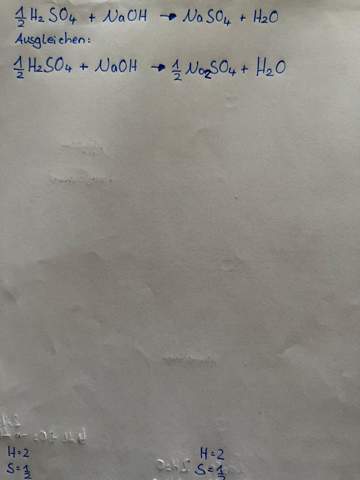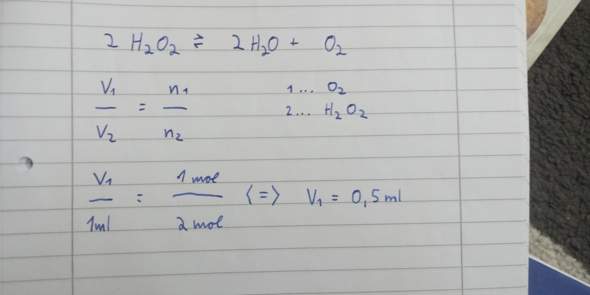Ideale Gase Aufgaben. Kann mir jemand hier helfen?
a) Der Sauerstoffgehalt der Luft ist konstant und beträgt 21 Vol.-%. Bei einer Temperatur von 22,5 °C und dem Atmosphärendruck (1,013 bar) atmet ein Mensch im Durschnitt 8,5 l Luft pro Minute im Ruhezustand. Der Sauerstoffgehalt der ausgeatmeten Luft beträgt 16 Vol.-%. Wieviel Mol Sauerstoff setzt der Mensch unter den oben genannten Bedingungen innerhalb von 24 Stunden um und wieviel Sauerstoffmolekülen entspricht das?
Mein Ergebnis: 252,64 mol Sauerstoff und eine Teilchenanzahl von 1,521*10^26
b) Feststoff A zerfällt zum Gas B und dem Gas C in dem folgenden stöchiometrischen Verhältnis: 1 A(s) → 1 B(g) + 1 C(g). Stellen Sie sich einen Kasten aus Metall mit Kantenlängen von jeweils 1 m vor, der nur den Feststoff A enthält (auch keine Luft). Der Würfel springt bei einer Kraft von Innen von 3,6×106 N auseinander.
(i) Wieviel Mol A muss im Kasten bei 628,89 °C im Moment der Explosion enthalten sein, damit die Explosion stattfindet? Tipp: Die Kraft wirkt dabei auf alle 6 Seitenflächen des Würfels.
Mein Ergebnis: 80,004 mol/2 -> Da das Verhältnis 1 zu 2 ist (bin mir hier etwas unsicher)
(ii) Welcher Energiebetrag war für die Erwärmung der Gase auf diese Temperatur notwendig, wenn die Temperatur vor dem Beginn der Reaktion 25 °C betrug? Nehmen Sie an, dass die bei der Reaktion freiwerdende Energie nur für die Erwärmung der Gase verbraucht wird. (2 Punkte)
Mein Ergebnis: 2,04*10^6 J
Gerne könnt ihr auch Rückfragen etc. stellen. Ich lerne gerade für eine Klausur und möchte sichergehen, dass meine Ergebnisse Sinn machen :)