Guten Abend,
ich benötige noch etwas Hilfe beim Lösen von Aufgaben zu Chemie. Alles was ich weiß, sowie bereits bestehende Fragen, habe ich als Antwort unterhalb der Aufgaben in eckige Klammern geschrieben.
Die Aufgaben habe ich einmal als Bild gepostet und einmal als Text unterhalb des Bildes (mit meinen Anmerkungen).
Ich freue mich sehr über eure Hilfe. :-)
Aufgabe 1
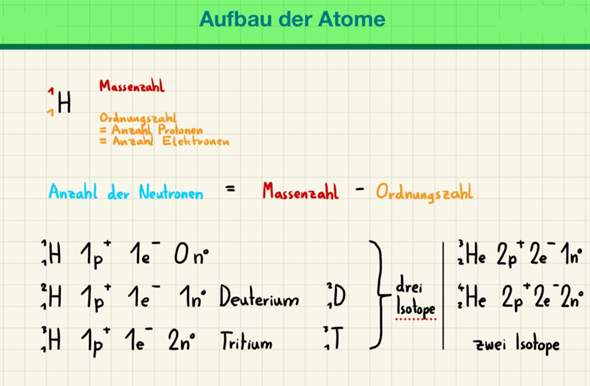
a) Welche Masse und welche Ladung hat ein Neutron?
[Das weiß ich leider nicht. Ich weiß nur, dass Neutronen eine neutrale Ladung haben. Und wie kommt man auf die Masse von einem Neutron? Wie kommt man auf die Masse von einem Elektron? Wie kommt man auf die Masse von einem Proton? Wie schreibt man die Masse davon jeweils in der richtigen Schreibweise?]
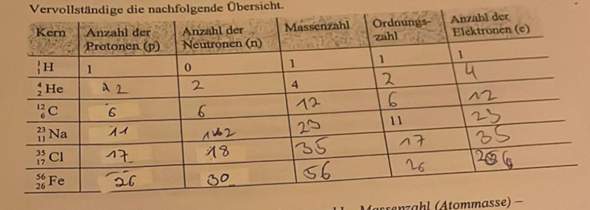
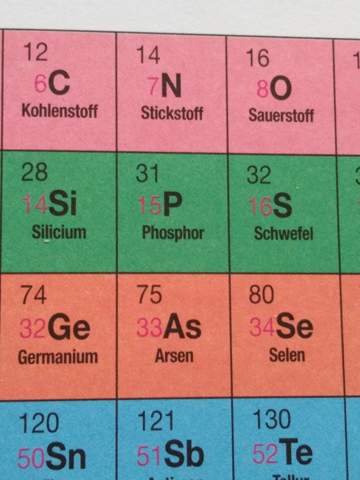
b) Welches Element hat 33 Protonen im Kern?
[Das Element As (also Arsen) hat 33 Protonen im Kern und 33 Elektronen in der Elektronenhülle (Atomhülle)]
c) Nennen Sie ein Element, dass 26 Neutronen im Kern hat.
[Das Element Ti (also Titan) hat eine Massenzahl von rund 48 und eine Protonenzahl (Ordnungszahl) von 22. Neutronenanzahl = Massenzahl - Protonenzahl (Ordnungszahl) = 48 - 22 = 26.]
d) Geben Sie ein Element an, dass 4 Elektronen in der Außenschale hat.
[Eigentlich wollte ich gerade Ti (also Titan) schreiben, da dort eine 4 steht, also bei der Gruppe. Jedoch handelt es sich hierbei ja um die Nebengruppen. Normalerweise kann man ja anhand der Gruppe sagen, wie viele Elektronen sich in der Außenschale befinden. Ist das nur bei den Hauptgruppen so? Ist das nicht bei den Nebengruppen so? Gibt es eine andere Regel für die Nebengruppen, wie viele Elektronen sich in der Außenschale befinden? Um sicher zu gehen (und nicht laut meinem bisherigen Kenntnisstand bei den Nebengruppen „rechnen“ zu müssen, wie viele Valenzelektronen die Nebengruppenelemente haben) nenne ich hier nun also ein Element mit der Hauptgruppe 4. Meine Antwort: Das Element C (also Kohlenstoff) hat in der Außenschale 4 Elektronen, da es die Hauptgruppe 4 hat.]
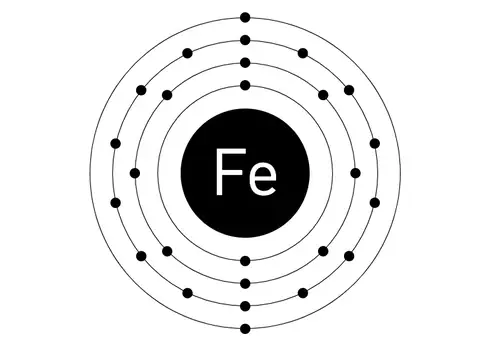
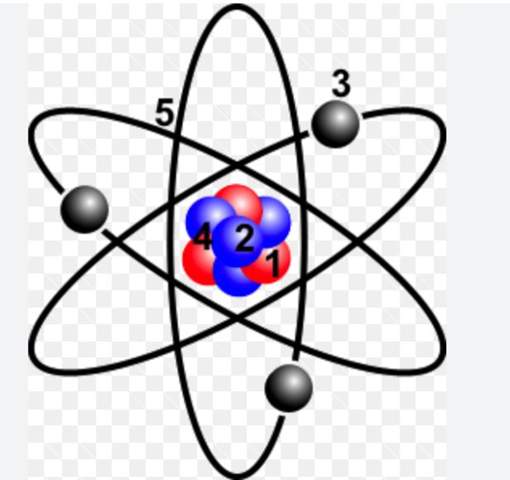
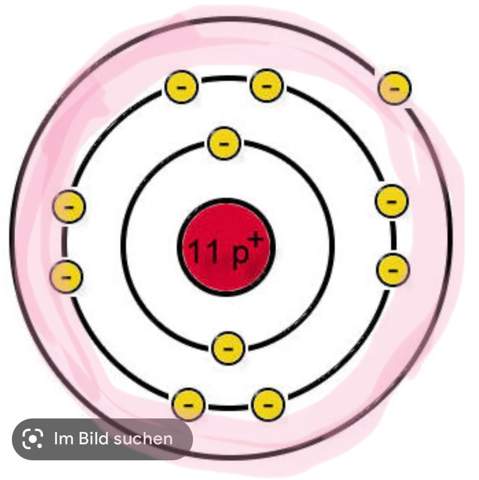
e) Wie ist das Gallium Atom aufgebaut? Geben Sie die genaue Verteilung und Anzahl aller im Galliumatom enthaltenen Elementarteilchen an.
[Bei dieser Fragestellung bin ich mir unsicher, ob ich einfach nur eine Zeichnung nach dem Bohrschen Atommodell machen muss, oder ob ich auch Text dazuschreiben muss. Hier meine bearbeitete Aufgabe:
]
Aufgabe 2
a) Erklären Sie die Metallbindung mit Hilfe einer Zeichnung an einem konkreten Beispiel.
b) Wie unterscheiden sich Metalle und Ionenverbindung bei der Verformbarkeit? Erklären Sie diese Unterschiede mit dem Bindungsmodell.
c) Geben Sie zu den folgenden Stoffen die vorliegende Bindungsart an. Aluminiumchlorid, Xenon, Wasserstoff
Aufgabe 3
a) Aus welchem Erz wird Aluminium großtechnisch hergestellt? In welcher Form ist das Aluminium darin enthalten?
b) Im Verfahren wird noch ein Hilfsstoff zugesetzt. Nennen Sie diesen Stoff und beschreiben Sie seine Wirkung im Verfahren. Welche Vor- und Nachteile ergeben sich durch die Verwendung dieses Stoffs?
c) Magnesium reagiert mit Stickstoff in einer Redox-Reaktion. Geben Sie die beiden Teilgleichungen für diese Reaktion an.
[Hierbei handelt es sich ja um Hauptgruppenelemente, Mg (also Magnesium) hat 2 Valenzelektronen und N (also Stickstoff) hat 5 Valenzelektronen. Streben hier nun beide Elemente ein „Elektronenoktett“ an? Was ist überhaupt ein „Elektronenoktett“? Sind das immer 8 Valenzelektronen oder kommt es immer auf die jeweilige Schale an? Die vierte Schale, also die N-Schale kann ja maximal 32 Elektronen haben, was wäre hier zum Beispiel ein „Elektronenoktett“? Wären das auch 8 Elektronen? Diese Aufgabe verstehe ich leider auch nicht.]
Aufgabe 4
Durch welches Experiment konnte gezeigt werden, dass Atome aus einem Kern und einer Hülle bestehen? Beschreiben Sie das Experiment und erklären Sie, welche experimentellen Beobachtungen mit dem Kern-Hülle-Modell erklärt werden konnten.