[Chemie] Aufbau der Atome?
Guten Abend,
leider verstehe ich diesen Aufschrieb zu Chemie noch überhaupt nicht - solche Schreibweisen habe ich zuvor noch nie in meinem Leben gesehen und ich weiß auch nicht, was ein Isotop ist. Dies ist mein erstes Schuljahr mit Chemie und ich hatte früher noch nie Chemie gehabt. Für was gibt es überhaupt diese Schreibweise mit der Massenzahl und der Ordnungszahl vor dem „H“ (Wasserstoff)?
Wiese gibt es hier mehrere Zeilen und wieso wird die Massenzahl in jeder Reihe um 1 größer? Wieso bleibt die Ordnungszahl auf der linken Seite neben dem Strich gleich und wieso ist rechts neben dem Strich die Ordnungszahl 2 und die Massenzahl 3 bzw. 4? Was ist Deuterium und was ist Tritium?
Wieso steht einmal „drei Isotope“ dort und einmal „zwei Isotope“?
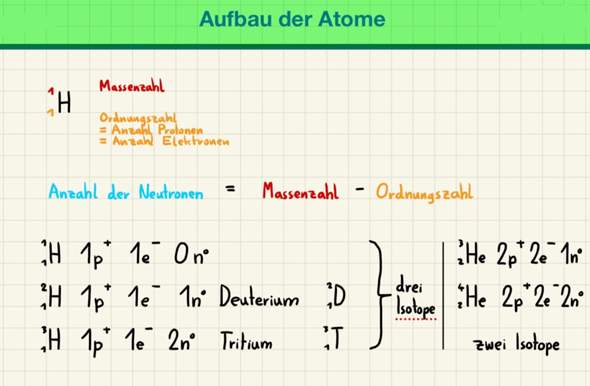
Ich freue mich über eine ausführliche und leicht verständliche Erklärung über diesen Aufschrieb sehr.
2 Antworten

Hi,
einen Teil zu der Frage, was die Zahlen bedeuten, habe ich dir schon gegeben. Wie bereits geklärt ist, bestehen Atome aus Protonen, Elektronen und Neutronen.
Für was gibt es überhaupt diese Schreibweise mit der Massenzahl und der Ordnungszahl vor dem „H“ (Wasserstoff)?
Die Ordnungszahl gibt Auskunft über die Protonen und Elektronen in einem (elektrisch neutralen) Atom. Die Massezahl ist die Summe aus Protonen und Neutronen. Subtrahierst du also die Ordnungszahl von der Massezahl, erhältst du die Anzahl der Neutronen, da das Atomgewicht maßgeblich durch die (nahezu gleiche) Masse von Protonen und Neutronen bestimmt wird.
Wiese gibt es hier mehrere Zeilen und wieso wird die Massenzahl in jeder Reihe um 1 größer?
Weil es hier um sogenannte Isotope geht. Wie du weißt, besteht ein Atom aus Protonen, Elektronen und Neutronen. Die Ordnungszahl eines Elements gibt die Anzahl an Protonen im Kern an. Kohlenstoff hat zum Beispiel die Ordnungszahl 6. Das heißt, Kohlenstoff hat sechs Elektronen und sechs Protonen. Du findest bei Kohlenstoff noch die Angabe 12 (Einheit meist u). Das ist die Atommasse. Die Summe aus Protonen und Neutronen (wiegen beide jeweils etwa 1 u) ergibt die Atommasse. Wenn du also sechs Protonen hast und die Atommasse 12 u ist, dann hast du auch sechs Neutronen im Kern.
Ein Isotop ist eine Atomart eines Elements, das eine bestimmte Anzahl an Protonen, Elektronen und Neutronen hat. Das heißt, das Kohlenstoffisotop ¹²C hat sechs Protonen, sechs Elektronen und sechs Neutronen. Die verschiedenen Isotope eines Elements unterscheiden sich durch die Anzahl der Neutronen. Die Anzahl der Protonen und Elektronen bleibt gleich. Das Kohlenstoffisotop ¹⁴C hat noch immer die Ordnungszahl 6, steht also an derselben Stelle im Periodensystem (isos = gleich, topos = Ort). Die Atommasse ist jetzt aber 14 u, also hat das Isotop 14 - 6 = 8 Neutronen. Die Isotope ¹²C und ¹⁴C unterscheiden sich also nur in der Anzahl an Neutronen.
Im Periodensystem der Elemente kannst du die Ordnungszahl und die Massenzahl desjenigen Isotops ablesen, das am häufigsten vorkommt. Deshalb findest du auch nur beim Kohlenstoff ¹²C aufgeführt - es ist das Isotop des Kohlenstoffs, das am häufigsten auf der Erde vorkommt. Bei Wasserstoff ist es nun so, dass im Periodensystem ¹H steht, weil das das häufigste Wasserstoffisotop ist. Wie eben erläutert, erhöht sich bei den Isotopen durch die zunehmende Neutronenzahl nur die Massezahl, sodass wir ²H und ³H als Wasserstoffisotope erhalten. Die Anzahl an Protonen und Elektronen bleibt also beide Male bei 1, nur die Anzahl auf Neutronen erhöht sich auf 1 bzw. 2.
Wieso bleibt die Ordnungszahl auf der linken Seite neben dem Strich gleich und wieso ist rechts neben dem Strich die Ordnungszahl 2 und die Massenzahl 3 bzw. 4?
Siehe Erläuterung zum vorherigen Punkt.
Zur rechten Seite: Dort sind nun Heliumisotope aufgeführt. Helium hat die Ordnungszahl 2 und die Massezahl 4, wenn man ins Periodensystem schaut. Das ist das häufigste Heliumisotop. Es gibt noch ein Heliumisotop, das nur ein Neutron hat und damit die Massezahl 3 trägt.
Was ist Deuterium und was ist Tritium?
So nennt man die Wasserstoffisotope: Deuterium ist ²H und Tritium ist ³H.
Wieso steht einmal „drei Isotope“ dort und einmal „zwei Isotope“?
Weil Wasserstoff drei Isotope hat und Helium nur zwei.
LG

Ordnungszahl = Zahl der Protonen und somit Elektronen = das nachtcein Element aus, das bestimmt die chemischen Eigenschaften.
Unterschiedliche Neutronen verändern physikalische Eigenschaften etwas. Daher sagt man selbes Element, aber Isotope (übersetzt selbe Stelle im Periodensystem)
Somit selbe Ordnungszahl aber unterschiedliche Atommasse in g/Mol (Einheit Dalton).
Wasserstoff hat 3 davon
He 2.

Guten Abend,
kannst du dir vielleicht meine neueste Frage zu Chemie ansehen? :) Dort habe ich ein paar Fragen, die mir nach dem Anschauen eines Videos zu „Salzformeln / Verhältnisformeln aufstellen“ aufgekommen sind, gepostet. Hier ist der Link zur Frage: https://www.gutefrage.net/frage/chemie-salzverhaeltnisformeln-aufstellen
Liebe Grüße
maennlich2002