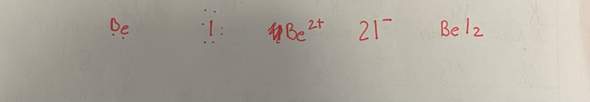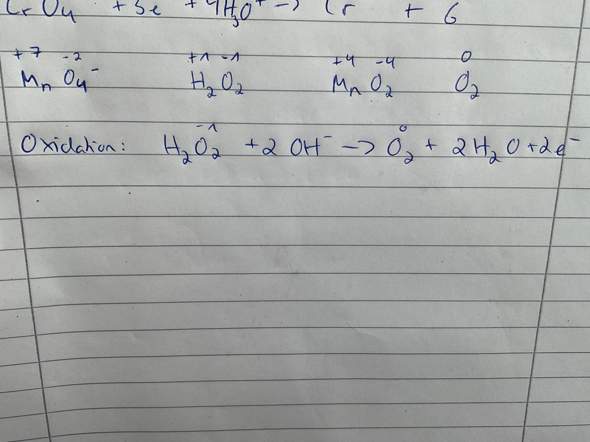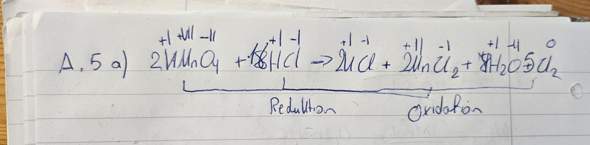Vervollsätndigen Sie die folgenden Gleichungen
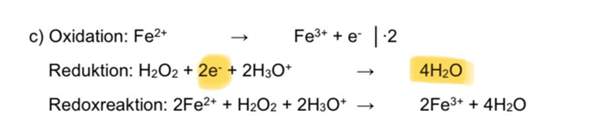
a) Fe^(2+) + + NO_3^(-) + [......] -> Fe^(3+) + NO + [.........] in saurer Lösung
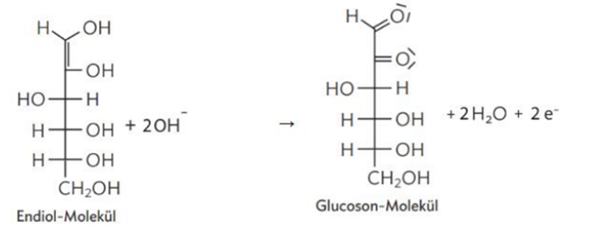
b) Mn^(2-) + H2O2 + [........] -> MnO2 + H2O in alkalischer Lösung:
Ansatz
a) Hätte gesagt:
Fe^(2+) + + NO_3^(-) + 2H -> Fe^(3+) + NO + H2O
Kommilitone meint: Fe^(2-) + + NO_3^(-) + 2H -> Fe^(3+) + NO + 2 H2O
Eine andere Kommiltonin meint: Fe^(2+) + + NO_3^(-) + 4H^(+) -> Fe^(3+) + NO + 2 H2O
Internet sagt 3 Fe^(2+) + + NO_3^(-) + 4H -> 3 Fe^(3+) + NO + 2 H2O
https://www.philus.de/reaktionsgleichung/153325464/3_fe2__no3-__4_h__3_fe3__no__2_h2o.html
Künstliche Intelligenz meint: 3 Fe^(2-) + 2NO_3^(-) + 6 H -> 3 Fe^(3+) + NO + 3 H2O
b) Hätte jetzt gesagt:
Mn^(2-) + H2O2 + 2OH^(-) -> MnO2 + 2 H2O.
Kommiliton meint, es müsste Mn^(2+) heißen. Im Internet taucht auch diese (2+)-Variante auf.
https://homework.study.com/explanation/balance-this-reaction-using-the-half-reaction-method-mn-2-plus-plus-h2o2-to-mno2-plus-h2o-basic-solution.html
Zu viele Ansätze verderben den Brei. Daher bitt ich um eine Rückmeldung, was genau jetzt stimmt. Und macht es für die Gleichung eigentlich nen Unterschied ob da jetzt Fe^(2+) oder Fe^(2-) steht? (Der Scan der Aufgabenstellung ist leider sehr undeutlich, daher können wir das selbst nicht erkennen).