[Chemie] Umgekehrte Redoxreaktion?
Guten Abend,
gibt es in der Chemie auch umgekehrte Redoxreaktionen? Handelt es sich bei Bild 2 um eine umgekehrte Redoxreaktion? Leider verstehe ich Bild 2 noch überhaupt nicht. Bild 1 habe ich gerade als Übung (habe mir selber die beiden Elemente „ausgedacht“) gemacht und eine „normale“ Redoxreaktion gebildet. Bild 1 habe ich verstanden.
Ich freue mich auf eure hilfreichen Antworten sehr.

3 Antworten

Dein Zettel mit dem Al ist richtig, wobei du den mittleren Block eigentlich weglassen kannst, das Erweitern auf kgV und das Zusammenfassen Ox+Red->Redox kann man in einem Schritt erledigen.
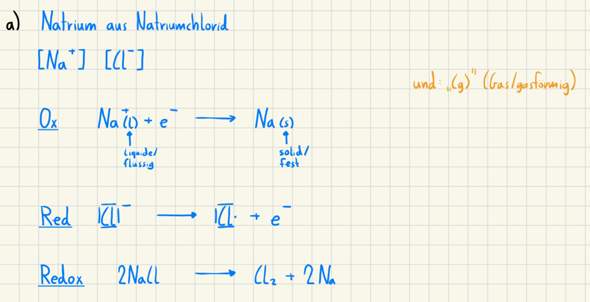
Die Reaktion von zu NaCl zu Na und Cl₂ läuft so nicht ab, man kann sie aber durch Elektrolyse erzwingen. Trotzdem ist in den Gleihchungen wieder Murks. Einzelne Ionen haben keinen Aggregatzustand, außer sie sind gelöst, dann schreibt man aber Na⁺(aq), aq=aqua. Kochsalz muss man aber schmelzen, sonst bildet sich Wasserstoff und keine Natrium. Bei 800 °C ist Na(s) aber wieder ein WItz, denn Natrium schmilzt schon bei gut 100 °C. Und auch Chlor bildet natürlich Moleküle.
Außerdem würfelt man nicht ohne Grund die Reihenfolge durcheinander.
2 NaCl -> 2 Na -> Cl₂ liest sich einfach flüssiger, deshalb schreibt man es besser so, auch wenn es anders nicht falsch ist.
Vielleicht will der Lehrer ja den Stoff für euch vereinfachen, aber wie er das macht ist nach meiner Meinung untauglich. Man darf nicht so sehr vereinfachen, dass es falsch wird.
Noch was: Man sollte sehr vorsichtig sein, sich Reaktionen auszudenken. Stoffe reagieren nicht immer so, wie man sich das denkt, ohne viel Erfahrung. Beim AlBr₃ hast du noch mal Glück gehabt, weil das auch bei Wikipedia so geführt wird. Es bildet aber eigentlich Moleküle der Formel Al₂Br₆.


Hi,
das oben auf Bild 1 ist komplett richtig. Ob man den Zwischenschritt weglässt, ist Geschmackssache. Kann man machen, wenn es dir aber hilft, so what.
Zu Bild 2: Die Reaktionen an sich hast du korrekt aufgestellt, allerdings sind Ionen nicht "flüssig", sondern "aquatisiert" (= im Wasser gelöst, Index aq).
Diese Reaktion gibt es zwar, aber sie funktioniert nur unter sogenannter Schmelzflusselektrolyse. Die Reaktion läuft bei 600°C ab, Natrium schmilzt schon bei 98°C. Das heißt: Das Natrium, das du über die Schmelzflusselektrolyse gewinnst, wird sicher noch keinen festen Aggregatzustand aufweisen.
Ich würde die Aggregatzustände hier daher generell einfach unerwähnt lassen.
Zu dem Ausdenken von Reaktionen hat ThomasJNewton schon ein paar Worte verloren. Hier kann ich dir den Tipp geben: Schau ins Internet. Dort findest du etliche Übungsaufgaben zu allen möglichen Themen. So beschaffe ich mir, wenn ich z. B. Nachhilfe gebe, auch die Aufgaben, anstatt mir alles selbst auszudenken. Bei "Metall und Nichtmetall" braucht man sich nicht allzu viele Sorgen machen, und natürlich ist chemisch alles oft viel komplexer, aber in Zukunft schaue besser im Netz nach Aufgaben zum Üben. Sie lösen und zur Kontrolle hier reinstellen kannst du ja immer noch. :-)
LG

Mir wäre zweiteres echt ein Rätsel... Falsche Beschriftung?
Ja, wenn du die Pfeile umdrehst bei der Oxidation bzw. Reduktion, wäre nun die Reduktion die Oxidation... und die Oxidation die Reduktion.
Da stelle sich die Frage inwiefern diese Reaktionen überhaupt realistisch sind.

Ist es denn richtig, wenn man die Wörter „Oxidation“ und „Reduktion“ tauscht?

Da hat die Lehrkraft das Grundprinzip der didaktischen Reduktion wohl nicht verstanden... ;-)